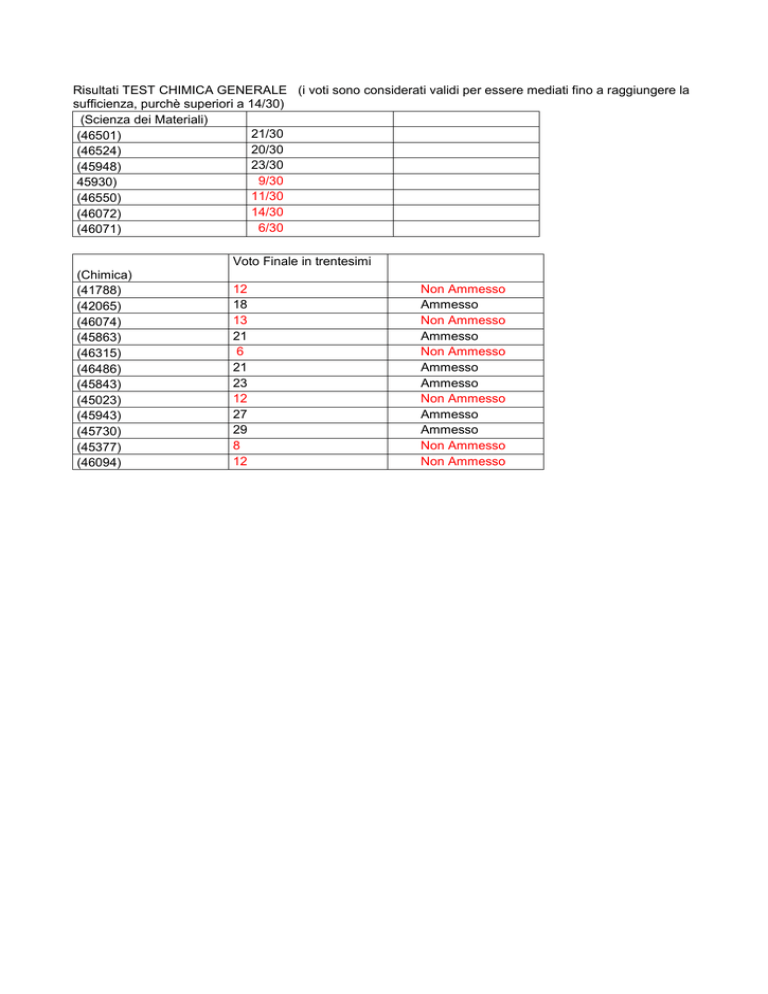
Risultati TEST CHIMICA GENERALE (i voti sono considerati validi per essere mediati fino a raggiungere la
sufficienza, purchè superiori a 14/30)
(Scienza dei Materiali)
21/30
(46501)
20/30
(46524)
23/30
(45948)
9/30
45930)
11/30
(46550)
14/30
(46072)
6/30
(46071)
Voto Finale in trentesimi
(Chimica)
(41788)
(42065)
(46074)
(45863)
(46315)
(46486)
(45843)
(45023)
(45943)
(45730)
(45377)
(46094)
12
18
13
21
6
21
23
12
27
29
8
12
Non Ammesso
Ammesso
Non Ammesso
Ammesso
Non Ammesso
Ammesso
Ammesso
Non Ammesso
Ammesso
Ammesso
Non Ammesso
Non Ammesso
Nome e Cognome
Test di Chimica Generale
CdL CHIMICA
N° di Matricola
Cagliari 16 Febbraio, 2011
Gof(kJ mol-1) PbO(s)= -189; PbO2(s)= -219.
Potenziale Standard di Rid.: Cu2+/Cu = +034 V; Ag+/Ag = +0.80 V.
1) L’elemento con numero atomico 15 è un (metallo, metalloide, non
metallo)______________con simbolo_____che appartiene al gruppo______ e
periodo______della tavola periodica. L'atomo ha _____ protoni nel nucleo, ha
configurazione elettronica _____________ e ______ elettroni di valenza nel guscio
esterno. Il suo peso atomico è 31.0; 15.5 grammi equivalgono a ________ moli e
contengono _________ atomi.
2) Prevedere la variazione nelle proprietà acido/base degli ossidi degli elementi del 3°
periodo.
3) Quale delle seguenti specie è un radicale? A) CO2; B) CO; C) N2O; D) NO.
4) Scrivere le formule di struttura secondo Lewis dell’anione fosfato, prevederne la forma
geometrica, calcolare il numero di ossidazione, la carica formale su ciascun atomo, e
l'ordine di legame PO.
5)
Disporre secondo la distanza di legame crescente NO-, NO+, NO, e giustificarne la
sequenza .
6) Indicare quale delle seguenti reazioni è del tipo acido-base secondo Lewis:
A) Mg(s)+ 2 HCl(aq) Mg2+(aq) + H2(g) + 2 Cl-(aq)
B) H2O(l) + HCl(g) H3O+ (aq) + Cl-(aq)
C) NH3 + H+ [NH4]+
D) Pb(s) + Cl2(g) 2 PbCl2 (s)
7) In quale delle seguenti reazioni l'acqua agisce da base di Broensted?
A) 2H2O(l) + 2F2(g) 4HF(aq) + O2(g).
B) H2O(l) + Ac-(aq)
AcH(aq) + OH-(aq) ;
+
C) H2O(l) + NH4 (aq)
H3O+(aq) + NH3(aq);
2+
D) H2O(l) + Mg(s) Mg (aq) + H2(g) + 2 OH-(aq)
8) Quale delle seguenti azioni sposta a destra la posizione di equilibrio della seguente
reazione
esotermica? CO(g) + H2O(g)
CO2(g) + H2(g)
A) Aumentare la temperatura; B) Aumentare la pressione; C) Aggiungere CO2; D)
Aggiungere CO.
9) Indicare in che verso è spontanea la seguente reazione e prevedere se la variazione di
entropia contribuisce in modo favorevole o meno alla spontaneità della reazione.
2 PbO(s)+ O2 (g) 2PbO2(s)
10) Indicare il catodo e l’anodo, calcolare la FEM della seguente pila, scrivere la reazione
coinvolta ed indicare in quali condizioni la FEM si annulla.
Cu/Cu2+(aq)//Ag+(aq)/Ag
Nome e Cognome
Test di Chimica Generale
CdL SCIENZA dei MATERIALI
N° di Matricola
Cagliari 16 Febbraio, 2011
1) L’elemento con numero atomico 20 è un (metallo, metalloide, non
metallo)______________con simbolo_____che appartiene al gruppo______ e
periodo______della tavola periodica. L'elemento ha _____ protoni nel nucleo, ha
configurazione elettronica ______________ e ______ elettroni di valenza nel guscio
esterno. Il suo peso atomico è 40.0; 20.0 grammi equivalgono a _________ moli e
contengono _________ atomi.
2) Prevedere la variazione nelle proprietà acido/base degli ossidi degli elementi del 3°
periodo.
3) Qual è il massimo e minimo numero di ossidazione per lo iodio?
4) Quale delle seguenti specie è un radicale? A) Br2; B) Br; C) H2; D) HBr.
5) Scrivere le formule di struttura secondo Lewis dell’anione fosfato prevederne la forma
geometrica, calcolare il numero di ossidazione, la carica formale su ciascun atomo, e
l'ordine di legame PO.
6)
Disporre secondo la distanza di legame crescente O22-, O2, O2- e giustificarne la
sequenza.
7) H2O è un liquido a temperatura ambiente, H2S è un gas. Quale tipo di forza intermolecolare è responsabile di questo comportamento?
8) Indicare quale delle seguenti reazioni è del tipo acido-base secondo Lewis:
A) Mg(s)+ 2 HCl(aq) Mg2+(aq) + H2(g) + 2 Cl-(aq)
B) NH3 + H+ [NH4]+
C) Pb(s) + Cl2(g) 2 PbCl2 (s)
D) H2O(l) + HCl(g) H3O+ (aq) + Cl-(aq)
9) In quale delle seguenti reazioni l'acqua agisce da base di Broensted?
A) 2H2O(l) + 2F2(g) 4HF(aq) + O2(g).
B) H2O(l) + Ac-(aq)
AcH(aq) + OH-(aq) ;
+
C) H2O(l) + NH4 (aq)
H3O+(aq) + NH3(aq);
2+
D) H2O(l) + Mg(s) Mg (aq) + H2(g) + 2 OH-(aq)
10) Quale delle seguenti azioni sposta a destra la posizione di equilibrio della seguente
reazione
esotermica? CO(g) + H2O(g)
CO2(g) + H2(g)
A) Aumentare la temperatura; B) Aumentare la pressione; C) Aggiungere CO2; D)
Aggiungere CO.