RB
Modificazioni genetiche
degli animali
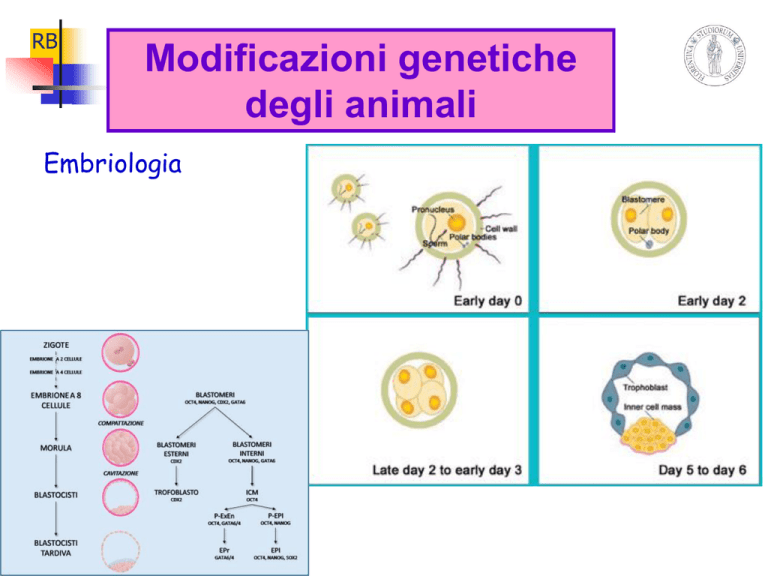
Embriologia
RB
Tre metodi principali per iniezione DNA esogeno
1. Iniezione nel pronucleo
2. Cellule staminali embrionali
3. Trasferimento nucleare
In passato si usavano anche i vettori retrovirali
Trasferiscono solo piccoli tratti ( 8 kb)
Genoma ceppo retrovirale si può integrare nel nucleo del
transgene
RB
RB
Iniezione pronucleo
Subito
dopo
la
fecondazione pronuclei
M e F distinti
Iniezione di DNA
pronucleo più grande
RB
DNA iniettato si può integrare nel DNA del pronucleo
Embrioni iniettati coltivati fino allo stadio di morula
In topo:
Iniettati in femmina
pseudo-gravida
(fecondata con maschio
vasectomizzato)
25-40 ovuli
RB
Topo che nascerà eterozigote per il carattere
Incrocio da due topi eterozigoti 25 % soggetti con gene in omozigosi
Primo esempio Supertopo Palmiter 1982
RB
RB
Vantaggi
Non è necessario clonare il frammento in un vettore
Svantaggi
Si può solo aggiungere e non togliere
Evento di integrazione è casuale e di difficile controllo
Livello di espressione del gene non è del tutto ereditario
Creazione di animali a mosaico
RB
Cellule staminali embrionali
Cellule indifferenziate isolate dalla massa cellulare della
blastocisti
Possono essere coltivate in vitro insieme a cellule
embrionali di topo (bloccate non si dividono)
Superficie idonea all’adesione delle cellule ES
POTENZIALITÀ DI DARE ORIGINE A TUTTI I TIPI
CELULARI PRESENTI NELL’ANIMALE ADULTO
RB
DNA esogeno può essere immesso in cellule ES
ES ricombinanti sono introdotte in una nuova blastocisti
Impianto in femmina pseudo-gravida
Progenie chimerica
RB
RB
Animale chimerico verrà incrociato con soggetti normali
per dare luogo a eterozigoti
Vantaggi ES cells
Efficienza nei meccanismi di ricombinazione omologa
Possibile ottenere dei transgeni mirati
RB
RB
Possibile ottenere dei transgeni mirati
Geni deleti o modificati
Attenzione Ricombinazione non-omologa
Costruito vettore sequenze 5’ e 3’ fiancheggiano
gene da eliminare clonate a dx e sx di un marcatore
di selezione (resistenza antibiotici)
Vettore contiene gene resistenza timidina-chinasi
(tk)
Frammento di DNA lineare con queste sequenze
transfettato interno cellule ES
Selezione cellule ES (tratt. Antibiotico)
Ulteriore selezione con ganciclovir analogo
sintetico 2’-deossiguanina fosforilato dalla
timidina-chinasi origina analogo del dGTP
inibisce polimerasi (se frammento inserito a caso la
cellula muore)
RB
Selezione positiva – negativa
Positiva: cellule che recano DNA
vettoriale integrato in qualsiasi
punto del genoma
Negativa: contro la sequenza del
DNA vettoriale integrato in siti
spuri
Seq. omologhe a
regioni sito bersaglio
Seq. resistenza G-418
Transgene
Geni timidina chinasi
RB
Selezione positiva – negativa
Trattando con G-418 sopravvivono
solo cellule che hanno integrato
Neor
Aggiunta composto che uccide
cellule che esprimono la timidinachinasi (ganciclovir) permette di
selezionare solo cellule che hanno
integrato la regione d’interesse
Doppio crossing-over
RB
Altra possibilità per verificare presenza di cellule ES
Uso della PCR
Vettore di indirizzamento due blocchi di DNA omologhi al sito target
Uno a ciascun lato
dell’insieme (transgene + sequenza DNA non presente in topo)
RB
Innesto complementare
sequenza interna a quella
DNA batterica clonata
presente nel vettore
Complementare a sequenza
DNA che è parte
cromosoma adiacente a uno
dei due blocchi omologhi
RB
Trasferimento nucleare
DNA contenuto in ogni cellula contiene tutte informazioni
Se riprogrammato può dare origine a nuovo individuo
Produzione di animali clonati:
• produzione proteine ricombinanti
• conservazione di specie animali in via d’estinzione
RB
Dolly
In estrema sintesi due passaggi:
1. Produzione di uova enucleate micromanipolazione
2. Introduzione di un nuovo nucleo
Volendo però entrare nel
dettaglio osserviamo come è
stata prodotta Dolly
Bonnie
RB
Cellule donatrici: tessuto della ghiandola mammaria di
pecora di 6 anni coltura cellulare primaria
90% cellule epiteliali mammella
cellule mio-epiteliali e fibroblasti
Induzione nelle cellule donatrici della
quiescenza (non nutrendo le cellule)
Cellule riceventi: oociti prelevati da pecore adulte
Scottish Blackface
28-33 ore dopo iniezione GnRH
RB
Fusione cellulare: indotta attraverso impulsi elettrici
277 fusioni cellulari
Crescita e impianto: cellule fuse coltivate in ovidutto di
pecora
6 giorni di coltura 29 su 277
2-3 embrioni trasferiti per animale
1 sola pecora ha portato a termine la gravidanza
RB
RB
Dolly chimera?
SI
DNA nucleare dei nuclei immessi
DNA mitocondriale oociti enucleati per la fusione
Problemi?
RB
Alcuni ….
1. Processo inefficiente
2. Embrioni con molte anormalità morte fetale e neonatale
3. Molto spesso la prole nata da clonazione è più pesante
alla nascita e dopo una gravidanza più lunga
4. Telomeri corti
5. Alterazioni del quadro di metilazione
Prospettive?
RB
Xenotrapianti
Rigetto organi (1,3) galattosil-transferasi (GGTA1)
Catalizza formazione disaccaride
galattosio- (1,3)-galattosio
sulla superficie delle cellule ed è alla base del rigetto
Produrre animali con GGTA1 sostituito
RB
TERAPIA GENICA
Ipotesi di base sostituire gene malato con uno wild
Gene wild produce la proteina normale e allevia sintomi
malattia
Applicabile (per ora) a malattie monofattoriali
sindromi genetiche recessive
sulle cellule germinali: proibita ovunque
su cellule somatiche: si modifica solo il genoma del paziente
RB
What are some recent developments in gene therapy
research?
Nanotechnology + gene therapy yields treatment to torpedo cancer.
March, 2009. The School of Pharmacy in London is testing a treatment
in mice, which delivers genes wrapped in nanoparticles to cancer cells to
target and destroy hard-to-reach cancer cells.
Results of world's first gene therapy for inherited blindness show
sight improvement. 28 April 2008. UK researchers have announced
results from the world’s first clinical trial to test a revolutionary gene
therapy treatment for a type of inherited blindness.
The results, published today in the New England Journal of Medicine,
show that the experimental treatment is safe and can improve sight.
The findings are a landmark for gene therapy technology and could have
a significant impact on future treatments for eye disease.


![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)









