Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
1
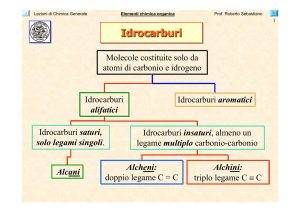
Idrocarburi
Molecole costituite solo da
atomi di carbonio e idrogeno
Idrocarburi
alifatici
Idrocarburi saturi,
solo legami singoli.
Alcani
Idrocarburi aromatici
Idrocarburi insaturi, almeno un
legame multiplo carbonio-carbonio
Alcheni:
doppio legame C = C
Alchini:
triplo legame C ≡ C
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
2
Tipiche geometrie ed ibridizzazioni del
carbonio negli idrocarburi
Alcano
Tetraedrica
Geometria
sp3
Ibridizzazione
Esempio:
nome
Formula
molecolare
Formula di
struttura
Alchene
Planare
sp2
Alchino
Lineare
sp
Aromatico
Planare
sp2
Propano
Propene
Propino
Toluene
C3H8
C3H6
C3H4
C7H8
H
H H
C
H
C
C
H H
H
H
H
H
H
C
C
C
H
H
H
C
H
H
H
H
C
C
C
H
H
H
C
C
H H
C
H
C
C
H
H
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
3
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
4
Idrocarburi ramificati
H3 C H H H
H3 C
H3C
H3C
CH3
C
CH3
C2H5
C
C
H
H H
CH3
H3C H
CH2
H
H
H
CH3
CH3
C
H
C
H3C
CH3
CH3
H3 C
CH3
H
H
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
5
C6 - C12
C11 - C16
C14 - C18
C15 - C25
(olii lubrificanti)
e oltre.
Distillazione
frazionata
del petrolio
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
6
Isomeri conformazionali
conformazionali::
esempio del nn--butano
butano:: C44H10
10
H
H
CH3
H3 C
H 3C
H
H
H
H
H
CH3
H
H
CH3
CH3
H
H
H
H3C
CH3
H
H
H
H
CH3
H
CH3
Anti (A)
H
CH3H
Eclissata (B)
H
H
H
CH3
H
H
H
H
H H
H
H
H
Sgemba (C, E)
H
H
H
CH3
CH3
H
H
H H
Eclissata (D)
4La conformazione anti è più stabile
della conformazione sghemba di 0.9
kcal/mole. A temperatura ambiente il
butano è al 72% in forma anti e al 28%
in forma sghemba.
4Le due forme sono separabili a -230°C.
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
7
Composti ciclicici
ciclicici::
anelli a 6 atomi di carbonio
Cicloesano
H
H
H
H
H
H
Conformazioni a sedia
Cicloesene
Adamantano
H
H
H
H
H
H
Conformazione a barca
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
Energie conformazionali di alcuni
cicloesani monosostituiti
4A causa delle interazioni steriche tra
un gruppo in posizione assiale e gli
idrogeni assiali, generalmente, le
conformazioni equatoriali risultano
più stabili delle corrispondenti
conformazioni assiali.
4Il metilcicloesano, ad esempio, a
25°C è presente circa al 95% nella
forma equatoriale.
8
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
Importanza della giunzione
giunzione::
esempio amido - cellulosa
4Il glucosio è uno zucchero che nella sua
forma ciclica assume la tipica
conformazione a sedia degli anelli a
sei atomi. A seguito della ciclizzazione
si genera un nuovo centro chirale in C1.
4La posizione assiale o equatoriale del
gruppo OH su C1, determina le forme α
o β del monosaccaride.
unità moltosio
amido
unità cellobiosio
cellulosa
4La polimerizzazione dell’una o
dell’altra forma porta a due
composti significativamente
diversi: l’amido e la cellulosa.
9
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
Atomo di carbonio primari,
secondari, terziari e quaternari.
4L’atomo di carbonio si dice:
4primario quando legato ad un solo atomo di carbonio
4secondario quando legato a due atomi di carbonio
4terziario quando legato e tre atomi di carbonio
4quaternario quando legato a quattro atomi di carbonio
primario
H 3C
H 3C
Energie di dissociazione per alcuni alcani
secondario
H H
CH3
quaternario
CH3
H
H
primario
10
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
11
Alogenazione degli alcani
CH3CH2CH3 + Br2
hν
Stadio di iniziazione:
Br2
2Br·
CH3CH2CH2Br + (CH3)2CHBr
1-Br-propano (8%)
2-Br-propano (92%)
Stadi di propagazione:
1) C3H8 + Br ·
C3H7· + HBr
C3H7Br + Br·
2) C3H7· + Br2
Stadi di terminazione:
Tutte le reazioni tra le specie
radicaliche.
Stadi di “strappo” dell’idrogeno:
1a) C3H8 + Br ·
CH3CH2CH2 · + HBr
(CH3)2CH · + HBr
1b) C3H8 + Br ·
∆H° = + 10.5 kcal/mole
∆H° = + 6.0 kcal/mole
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
Introduzione ai gruppi
funzionali organici
organici..
12
4 La varietà della chimica del carbonio è alla base dell’enorme estensione e
complessità della chimica organica.
4 Ciò nonostante, molte proprietà chimico-fisiche dei composti organici
possono essere spiegate e previste analizzando solo piccoli gruppi di atomi,
chiamati gruppi funzionali, che presentano caratteristiche strutturali e
reattività chimica tipiche e peculiari, perlatro influenzate, più o meno
significativamente, dal resto della molecola di cui fanno parte.
4Negli idrocarburi i gruppi funzionali sono rappresentati essenzialmente dalle
insaturazioni (legami doppi, tripli, coniugati ecc.) presenti, ma la grande
maggioranza dei composti organici presentano gruppi funzionali contenenti
eteroatomi, vale a dire atomi diversi da carbonio e idrogeno.
4I gruppi funzionali più comuni ed importanti implicano come eteroatomi solo
l’ossigeno e/o l’azoto e gli alogeni. Altri gruppi sono caratterizzati dalla
presenza di zolfo, silicio e fosforo.
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
13
Eteri
R-O-R’
Sono composti aventi due gruppi organici legati allo stesso
atomo di ossigeno. I residui organici possono essere gruppi
alchilici, arilici, vinilici e l’ossigeno può far parte di una
catena o di un ciclo.
CH3-CH2
O
O CH2-CH3
Etere etilico
CH3
Metilfeniletere
(Anisolo)
O
O
Tetraidrofurano
(THF)
Ossido di etilene
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
14
Alogenuri alchilici
R-X: con X = F, Cl, Br, I
4Generalmente liquidi, immiscibili e più densi dell’acqua.
4Oltre che come reagenti chimici, sono stati ampiamente usati in
grosse quantita’ come solventi e nel lavaggio a secco ma il loro uso
viene attualmente molto limitato essendo risultati epatotossici e
cancerogeni.
4Tipiche reazioni sono le sostituzioni nucleofile:
H
Y
e le eliminazioni:
+ RH
δ+
X
δ−
Cl
H3C
Y
R
H
H
+
X
KOH alcolica
H3C
CH2
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
15
Alcoli
R-OH
4Composti con punto di ebollizione abbastanza elevato a causa della
presenza di legami idrogeno
4Metanolo, etanolo e propanolo (C1 C2 e C3) sono perfettamente
miscibili in acqua mentre gli omologhi superiori risultano
progressivamente sempre meno miscibili divenendo preponderante
la componente idrofobica (idrocarburica) della molecola (vedi
tabella).
4La presenza di più gruppi OH nella molecolea (es. zuccheri) ne
favorisce la solubilità in solventi polari.
4Reazioni con rottura del legame R - OH
H3C
H2SO4
OH
etanolo
H3C
OH
CH2
H2C
+
OH2
etilene
+
PCl5
H3C
Cl
cloroetano
+
POCl3
+
HCl
Natura
basica
del
gruppo
OH
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
16
4Reazioni con rottura del legame RO-H:
2Na
+ CH CH OH
3
CH3CH2O -
2
Na+
+
H2
Natura acida
del gruppo OH
4Reazioni di ossidazione del gruppo alcolico:
H3C
n.o. 0 CH
3
n.o. +2 CH
K2Cr2O7
3
H3C
H2SO4
O
OH
chetone
H3C
H
n.o. -1
OH
K2Cr2O7
H2SO4
n.o. +1 K2Cr2O7
H3C
O
aldeide
H2SO4
O
H3C
n.o. +3
OH
acido carbossiclico
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
17
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
18
Ammine alifatiche
R-NH2; R-NHR’; R-NR’R”
4Si tratta di composti che formalmente possono essere visti
come derivati dell’ammoniaca dove uno o più atomi di
idrogeno sono stati sostituiti con uno o più gruppi alchilici.
4Si hanno così ammine primarie, secondarie e terziarie:
H
..
..
..
N
N
N
H
R
H
R'
R
R
R'
R"
4 Le ammine sono molecole polari e basiche che possono formare
energici legami idrogeno (meno afficaci nelle ammine terziarie).
Ciò giustifica l’andamento dei punti di ebollizione e la notevole
solubilità in acqua di quelle a minor peso molecolare.
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
19
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
4Oltre a essere tipiche basi di Lewis, le ammine si
comportano come basi di Brønsted:
R2NH(aq) + H2O(l)
[R2NH2]+(aq) + OH-(aq)
4Le ammine come nucleofili:
..
CH3
N
H
R'
R
I
+
CH3
H
R'
N
R
I
Sale
d’ammonio
quaternario
20
Lezioni di Chimica Generale
Elementi chimica organica
Composti carbonilici
Prof. Roberto Sebastiano
R
R
O
O
21
R'
R'
σ(C-O)*
E
4Polarizzazione del
gruppo carbonilico e
sua tipica reattività:
π(C-O)*
2pz
sp2
attacco elettrofilo
≈
π(C-O)
2pz
sp2
R
δ+
δ-
O
σ(C-O)
R'
C
O
O
attacco nucleofilo
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
22
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
23
Tautomeria cheto
-enolica
cheto-enolica
H
O
O
O
CH3
H3C
O
O
CH3
H3C
H
H
H
O
CH3
H3C
H
H
acetilacetone
O
O
O
CH3
H3C
H
H
OH-H2O
O
CH3
H3C
H
Ione
acetilacetona
to
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
24
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
25
O
O
Acidi carbossilici
R
R
OH
OH
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
26
O
R
O
OH
+
H2O
R
O
+
H3O+
Lezioni di Chimica Generale
Elementi chimica organica
27
O
O
+
Cl
R
acilcloruro
R'OH
OR'
R
alcol
+
HCl
estere
O
O
R
Prof. Roberto Sebastiano
OR'
+
estere
R"NH2
ammina
ammide
O
2
OH
acido
carbossilico
-H2O
R
R'OH
alcol
O
O
PCl5
R
NHR"
R
+
O
anidride
R
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
28
Polimeri
4Polimerizzazione radicalica
R
+ HC
CH2
CH2.
+
R
2
R
R
CH2 .
H2C
+
CH2
H2C
CH2.
R
CH2
CH2 .
R
n
CH2 .
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
29
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
30
4Steroisomeria nei polimeri
4Polipropilene
isotattico
sindiottico
atattico
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
31
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
32
4Policondensazione
OH
O
O
O
+
n OH-CH2CH2-OH
O
O
HO
O
Acido tereftalico
glicol etilenico
O
+
H3N
Poliestere
(Dacron)
O
O
O
R
aminoacido
+
+
H3N
-H2O
+
H3N
aminoacido
R'
O
NH
O
R'
n
R
O
Legame peptidico
dipeptide
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
33
Preparazione Nylon 6,10
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
34
Struttura delle Proteine
• Planarità del gruppo ammidico (-CO-NH-)
legame ammidico
(parzialmente doppio)
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
35
Struttura delle Proteine
• proteine fibrose a catene ad αN elica
N
N
passo dell’elica
piccola - 5,1 Å
N
N
N
N
passo dell’elica
grande - 61,2 Å
N
N
N
N
Avvolgimento di catene ad
α-elica con formazione di
cavi a tre o sette fili .
Lezioni di Chimica Generale
Elementi chimica organica
Prof. Roberto Sebastiano
36
Struttura delle Proteine
• Proteine globulari (emoglobina, enzimi vari)
Principali Interazioni che
stabiliscono la struttura
terziaria delle proteine.
Elettrostatica
H
+
N H
H
Ponti disolfuro
Idrofobica
O
S
S
H
H
C H H C
H
Altri legami ad H
O
- C
O-H
H
O=C