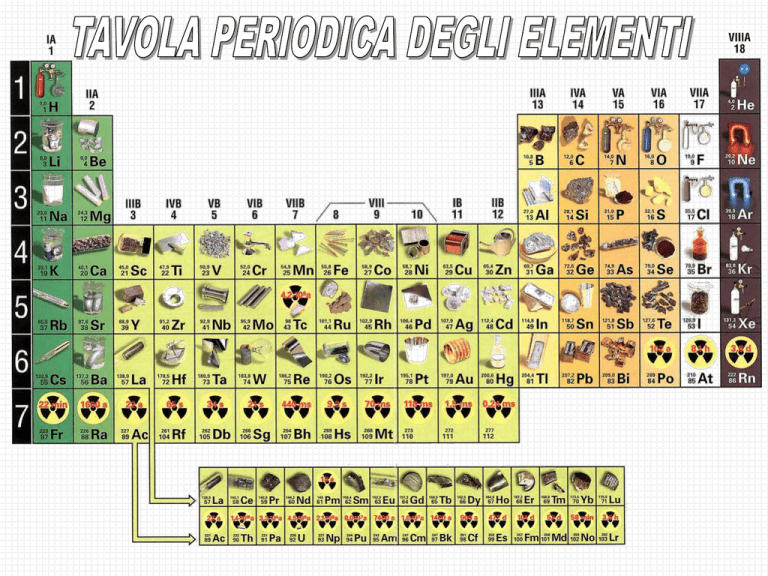
Tavola Periodica
• Lo schema complessivo della tavola periodica fu scoperto dal
chimico russo Mendeleev nel 1869. Ordinò gli elementi in gruppi e
periodi secondo i valori crescenti del loro peso atomico e tenendo
conto delle analogie fra le loro proprietà chimiche
• la tavola periodica è divisa in blocchi, dall'ultimo sottolivello occupato in base al principio di
Aufbau; gli elementi appartenenti ai blocchi s e p sono detti elementi dei gruppi principali.
• il numero del periodo di un elemento corrisponde al numero quantico principale del guscio di
valenza dei suoi elettroni.
• il numero del gruppo corrisponde alla somma dei numeri degli elettroni s e p presenti nel
guscio di valenza. Tutti i membri dello stesso gruppo hanno la stessa configurazione di valenza
(con valori differenti di n).
orbitali p
orbitali s
He
H
Li
Be
orbitali d
Na Mg
K
Ca Sc Ti
Rb Sr
Y
V
Cr Mn Fe Co Ni
B
C
N
O
F
Ne
Al Si
P
S
Cl
Ar
Cu Zn Ga Ge As Se Br Kr
Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te
Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi
I
Xe
Po At Ra
Fr Ra Ac
orbitali f
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa
U Np Pu Am Cm Bk Cf Es Fm Md No Lr
Gruppi
1/IA
Periodi
1
2
3
I gruppi sono individuati
da numeri romani e dalle
lettere A o B
2/IIA
3/IIIB
18/VIIIA
13/IIIA
11/IB
4
5
6
7
I periodi sono
individuati da numeri
La Tavola Periodica degli Elementi è formata da 7 periodi e 18 gruppi
NOMI COMUNI DI ALCUNI GRUPPI
Periodicità delle proprietà
Le proprietà atomiche degli elementi dipendono dalla loro configurazione
elettronica e mostrano una sorprendente periodicità: variano in maniera
ricorrente lungo ciascun periodo e gruppo della tavola periodica
• Dimensioni degli atomi
• Energia di ionizzazione
• Affinità elettronica
• Elettronegatività
Raggio atomico: Metà della distanza tra atomi nel campione dell’elemento
• Le dimensioni di un atomo sono determinate dalla distribuzione degli elettroni
più esterni
• Non e’ possibile determinare sperimentalmente le dimensioni di un atomo
isolato
Diminuzione
lungo il periodo
Aumentando il numero di elettroni nello stesso guscio
orbitalico aumenta l’attrazione con i protoni nucleari
causando una contrazione
Aumento
scendendo lungo
il gruppo
Si occupa un
guscio
orbitalico
con numero
quantico
principale n
maggiore
e quindi più
voluminoso
raggi atomici
Raggi atomici per gli elementi di transizione
- Da sinistra a destra lungo un periodo i raggi diminuiscono per i primi elementi,
successivamente non c’è variazione e verso la fine c’è un aumento dei raggi atomici.
- Elettroni dello strato ns + e- dello strato n-1 = aumento carica nucleare effettiva
cancellato dalla repulsione degli e-
Gli ioni
Gli atomi carichi elettricamente si dicono ioni e si parla di ioni positivi (cationi) o ioni
negativi (anioni) a seconda della carica indicandoli con il valore ed il segno della
carica in alto a destra del simbolo dell’ elemento
-
H + 1e
→ H
H
+
→ H
ANIONE
+ 1e
CATIONE
Energia di ionizzazione
E’ la minima energia necessaria per rimuovere un elettrone dallo stato
fondamentale di un atomo gassoso (formazione di un catione)
• l'energia di prima ionizzazione I è la minima energia necessaria per
rimuovere un elettrone da un atomo neutro E gassoso:
E(g) + I -> E+(g)+e-(g)
energia necessaria = I
• l'energia di seconda ionizzazione I2 è la minima energia necessaria per
rimuovere un elettrone dal catione con carica elettrica unitaria:
E+(g)+ I2 -> E2+(g) + e-(g)
energia necessaria = I2
L’E di ionizzazione è sempre positiva!
Nessun elemento isolato ha tendenza a perdere spontaneamente un elettrone
e quindi bisogna fornire E per rimuoverlo!
L’ Energia di Ionizzazione aumenta spostandosi verso destra e verso l’alto
nella tavola periodica degli elementi
• aumenta nel periodo:
atomi diventano più piccoli,
gli elettroni sono più vicini
ad un nucleo più fortemente
carico
• diminuisce nel gruppo:
perchè l'elettrone più
esterno e’ più distante dal
nucleo
• Le basse energie di
ionizzazione giustificano il
carattere metallico.
Un elemento allo stato
metallico è costituito da un
insieme di cationi circondati da
un mare di elettroni
N. B. : Al diminuire del raggio atomico, aumenta l’E di ionizzazione
Affinità elettronica
E’ la variazione di energia che si verifica quando un atomo gassoso acquista un
elettrone (formazione di anione)
A(g) + e- -> A-(g)
Si dice che un elemento ha
una elevata affinità elettronica
quando forma un anione
in modo esotermico (rilascia energia)
Gli atomi della maggior parte degli elementi hanno Affinità Elettronica < 0
Eccezioni: gas nobili, Be (2s2), Mg (3s2), N (2s2 2p3)
Prova che ci sono delle configurazioni elettroniche relativamente più stabili
Elettronegatività
tendenza di un atomo ad attrarre su di sè gli elettroni di un legame
Elettronegatività ∝
AUMENTO
DIMINUZIONE
Energia di ionizzazione + Affinità elettronica
METALLI, NON METALLI e METALLOIDI
Sono chiamati METALLI gli elementi con bassa affinità per
l’elettrone e basso valore della energia di ionizzazione:
formano cationi
• sono elementi METALLICI quelli del primo e del secondo gruppo
della tavola periodica
• gli elementi di transizione hanno carattere metallico
• si definiscono NON METALLI gli elementi del V-VII gruppo
• gli elementi del III gruppo hanno caratteristiche intermedie e
vengono definiti elementi ANFOTERI
Il carattere metallico va in direzione opposta all’elettronegatività
metalli
metalloidi
non metalli
Alcuni degli elementi conosciuti
Il Numero di Avogadro
e il concetto di mole…
PESO MOLECOLARE
Il peso molecolare di una sostanza è la somma dei pesi atomici di
tutti gli atomi nella molecola della sostanza.
H2O
PA(H)=1,0 u.m.a.
PA(O)=16,0 u.m.a.
PM(H2O)=2 x 1,0 + 16,0 =18,0 u.m.a.
NaCl
PA(Na)=22,99 u.m.a.
PA(Cl)=35,45 u.m.a.
PM(NaCl)=22,99 + 35,45 =58,44 u.m.a.
H2SO4
massa molecolare = 2×1,008 + 32,066 + 4×15,999 = 98,078
C6H12O6
massa molecolare = 6×12,011 + 12×1,008 + 6×15,999 =180,156
FORMULA CHIMICA
E' una notazione che usa i simboli atomici con dei numeri a pedice
per indicare le quantità relative degli elementi che costituiscono la
sostanza.
In tale accezione è anche nota come formula empirica o formula
minima.
NaCl ->
1:1
Al2O3
-> 2:3
Questo è il tipo più semplice di formula chimica.
Formula molecolare: è una formula chimica che dà l'esatto numero degli atomi
presenti in una molecola.
H2O
Formula di struttura: mostra come sono legati fra di loro gli atomi di una
molecola.
O
H
H
FORMULA MOLECOLARE
La formula molecolare di un composto è un multiplo della sua formula
empirica
Formula empirica
NO2
Formula molecolare
NO2
N2O4
N3O6
(NO2)n
Si ha ovviamente
Peso molecolare = n × peso formula empirica
Se da altre misure è noto il peso molecolare si ha
peso molecolare
n=
peso formula empirica
Ad esempio se nel problema del calcolo della formula empirica di
NO2 si conoscesse che il peso molecolare del composto vale 92,0
92,0
n=
= 2,00
14,0 + 2 × 16,0
E quindi la formula molecolare è
(NO2)2
Ovvero
N 2O 4
MOLE E NUMERO DI AVOGADRO
Una mole è definita come la quantità di una data sostanza che
contiene un numero di particelle (atomi, molecole, etc) pari al numero
di atomi contenuti in 12 grammi di 12C.
Il numero di atomi in un campione di 12 g di
Numero di Avogadro
12C
è chiamato
NA=6,022 x 1023
UNA MOLE DI SOSTANZA CONTIENE SEMPRE LO STESSO
NUMERO DI PARTICELLE, INDIPENDENTEMENTE DAL tipo
di SOSTANZA.
NA di particelle (atomi, molecole, etc.) = 1 mole
Una mole di particelle =
un numero di Avogadro di particelle
1,0 mol di
atomi di carbonio
6,022×1023
= atomi di carbonio
1,0 mol di
molecole di ossigeno
6,022×1023
= molecole di ossigeno
1,0 mol di
elettroni
6,022×1023
= elettroni
MASSA MOLARE
La massa molare di una sostanza è la massa (g) di una
mole.
(Per definizione il carbonio12 ha massa molare di 12 g)
Le unità di massa molare sono g/mol.
Per tutte le sostanze la massa molare in grammi è
uguale al peso molecolare in u.m.a.
1,0 mol di
atomi di Na
=
6,022×1023 =
Atomi di Na
Moli X grammi = grammi
1 mol
22,99 g/mol
Grammi X 1 mol = moli
grammi
Calcolo delle moli:
n (moli) = massa in grammi (g)
PM (peso molecolare) g/mol
1)
grammi ⇒ moli
A quante moli corrispondono 10,0 g di C2H5OH ?
PM(C2H5OH) =12,0 x 2 +16,0 + 6 x 1,01= 46,1 u.m.a.
Massa molare (o peso molecolare) = 46,1 g/mol
n=
10,0 g
= 0,217 mol
46,1 g/mol
massa( g)
numero di moli (n) =
massa molare (g/mol)
2)
Moli ⇒
grammi
Quanto pesano 0,0654 moli di ZnI2 ?
PM(ZnI2)= 65,39 + 126,90 x 2= 319,2 u.m.a.
Massa molare di ZnI2= 319,2 g/mol
Peso = 0,0654 mol x 319,2 g/mol= 20,9 g
Massa di un atomo
Quanto pesa un atomo di cloro?
Massa molare di Cl= 35,5 g/mol
1 mole contiene NA=6,022x1023 molecole/mol
35,5 g/mol
- 23
massa atomo Cl =
=
×
5,90
10
g/atomo
23
6,022 × 10 atomi/mol
Numero di molecole per una data massa
Quante molecole ci sono in 3,46 g di HCl?
PM(HCl)= 1,0 + 35,5=36,5
n HCl
3,46 g
=
= 0,0948 mol
36,5 g/mol
Numero di molecole = 0,0948
molecole/mol = 5,71⋅1022 molecole
mol
x
6,02⋅1023
Percentuali in peso dalla formula
Per un atomo A in una data molecola
massa di A nel totale
massa % A =
× 100
massa totale
Esempio
Calcolare le percentuali in peso di C, H ed O in CH2O
PA(C)= 12,0
PA(H)= 1,01
PM(CH2O)=12,0 + 2 x 1,01 + 16,0 = 30,0
PA(O)= 16,0
1 mole ⇒ 30,0 g
12,0 g
massa % C =
×100 = 40,0 %
30,0 g
2 ×1,01 g
massa % H =
×100 = 6,73 %
30,0 g
16,0 g
massa % O =
×100 = 53,3 %
30,0 g
N.B.
% O = 100% -40,0% -6,73%= 53,3%
Problemi:
1) Quanti grammi di carbonio ci sono in 83,5 g di CH2O?
Dal problema precedente abbiamo visto che il carbonio costituisce il 40%
della massa totale.
massa di C
massa di C
massa % C = 40,0 =
× 100 =
× 100
massa totale
83,5 g
83,5 g
massa di C = 40,0 ×
= 33,4 g
100
Determinazione della formula empirica
Un composto di azoto ed ossigeno contiene 0,483 g di N e 1,104 g di O.
Quale è la formula empirica del composto?
N
0,483 g
= 0,0345 mol
14,0 g/mol
O
1,104 g
= 0,0690 mol
16,0 g/mol
N0,0345O0,0690 ?
Per ottenere i numeri interi più piccoli si divide ciascun numero di
moli per il più piccolo tra quelli ottenuti prima
N
0,0345
= 1,00
0,0345
O
0,0690
= 2,00
0,0345
La formula empirica è
NO2
Si noti che NON è possibile conoscere la formula molecolare ESATTA,
perché potrebbe essere:
NO2
N2O4
N3O6 . . . . .
Un composto è costituito come segue:
17,5 % Na
39,7% Cr
42,8% O
Quale è la sua formula empirica?
Si fa riferimento a 100 g di composto che conterranno 17,5 g di Na,
39,7 g di Cr e 42,8 g di O
Na
17,5 g
= 0,761 mol
23,0 g/mol
Cr
39,7 g
= 0,763 mol
52,0 g/mol
O
42,8 g
= 2,68 mol
16,0 g/mol
più piccolo
Na
0,761
= 1,00
0,761
× 2 = 2,00
Cr
0,763
= 1,00
0,761
× 2 = 2,00
O
2,68
= 3,52
0,761
× 2 = 7,04
Na2Cr2O7
Il 2-desossiribosio, uno zucchero costituente il DNA, è costituito solo da
carbonio, idrogeno e ossigeno. Un chimico vuole determinare la sua
formula empirica per combustione ed ottiene una percentuale in massa di
carbonio pari al 44,77% di C e pari al 7,52% di H.
Quale è la formula empirica del 2-desossiribosio ?
Si fa riferimento a 100 g di composto che conterranno 44,77 g di C,
7,52 g di H e (100-44,77-7,52) = 47,71 g di O
C
44,77 g
= 3,727 mol
12,01 g/mol
H
7,52 g
= 7,46 mol
1,01 g/mol
O
47,71 g
= 2,982 mol
16,0 g/mol
più piccolo
C
3,727
= 1,25
2,982
× 4 = 5,00
H
7,46
= 2,50
2,982
× 4 = 10,0
O
2,982
= 1,00
2,982
× 4 = 4,00
C5H10O4










