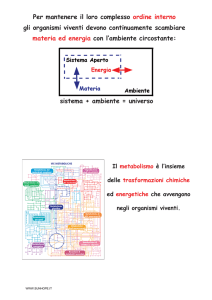
Per mantenere il loro complesso ordine interno gli
organismi viventi devono continuamente scambiare
materia ed energia con l’ambiente circostante:
sistema + ambiente = universo
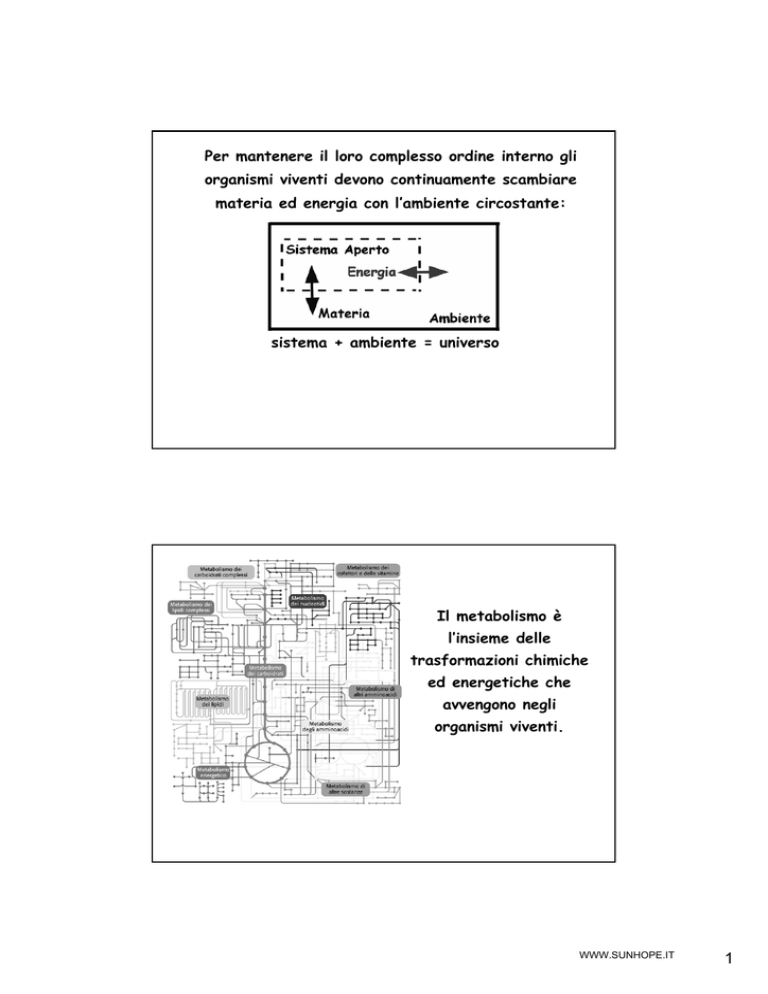
Il metabolismo è
l’insieme delle
trasformazioni chimiche
ed energetiche che
avvengono negli
organismi viventi.
WWW.SUNHOPE.IT
1
WWW.SUNHOPE.IT
2
La Bioenergetica è lo studio quantitativo
delle trasformazioni energetiche che
sono associate alle reazioni chimiche.
Queste trasformazioni obbediscono
alle leggi della Termodinamica.
Leggi della Termodinamica
1a Legge
L’energia totale dell’universo è costante
(principio di conservazione dell’energia)
2a Legge
Un processo può avvenire spontaneamente
soltanto se l’entropia dell’universo aumenta
WWW.SUNHOPE.IT
3
Ad una certa T, lo stato energetico di un sistema
chimico può essere descritto in termini di:
H = entalpia (contenuto termico)
S = entropia (grado di disordine)
G = energia libera di Gibbs
(energia utile a compiere un lavoro)
Le variazioni di G, H, S sono tra loro correlate
dall’equazione
∆G = ∆H - T∆S
∆G<0
Né ∆H né ∆s, ma solo ∆G può permettere
di predire la spontaneità di una reazione.
WWW.SUNHOPE.IT
4
∆G: standard chimico
pH=0
∆G’: standard biochimico pH=7
∆G è espresso in
kcal/mole
o in
kJoule/mole (1 kcal=4.2 kJ)
Il ∆G’ dipende solo dallo
stato energetico iniziale
e da quello finale
e non dalla via seguita
dalla trasformazione.
WWW.SUNHOPE.IT
5
∆G’ può predire
la direzione di una reazione,
ma non la velocità
che dipende solo dalle
proprietà dell’enzima che
catalizza quella reazione.
Una reazione con un ∆G’ fortemente negativo
non necessariamente procederà rapidamente.
WWW.SUNHOPE.IT
6
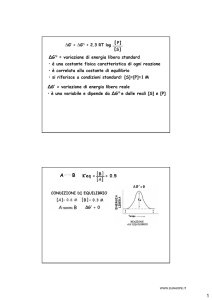
Se ∆G’= 0
la reazione è all’equilibrio
∆G’0 è quindi correlata alla costante di equilibrio
∆G’0, o variazione di energia libera standard,
• è una costante fisica caratteristica di ogni reazione
• si riferisce a condizioni standard:
temperatura
298 K
pressione
1 atmosfera
concentrazione [S]=[P]=1 M
∆G’ = variazione di energia libera reale
• è una variabile e dipende da ∆G’0 e dalle reali [S] e [P]
WWW.SUNHOPE.IT
7
∆G’0 = -2.3 RT log K’eq
K’eq
ΔG’0
103
-4.1
102
-2.7
101
-1.4
1
0
10-1
1.4
10-2
2.7
10-3
4.1
WWW.SUNHOPE.IT
8
Una reazione termodinamicamente non favorevole
può essere trascinata da una reazione favorevole
ad essa accoppiata, che, spesso, corrisponde
all’idrolisi dell’ATP.
Le variazioni di energia libera sono additive.
WWW.SUNHOPE.IT
9
Mentre le variazioni di energia libera sono additive,
le costanti di equilibrio sono moltiplicative:
l’idrolisi dell’ATP fa aumentare la K’eq della
formazione del Glc6P di 2x105 volte
(2x105 = K’eq dell’idrolisi dell’ATP).
WWW.SUNHOPE.IT
10
WWW.SUNHOPE.IT
11