Dispense CHIMICA GENERALE E ORGANICA (STAL)
2011/12
Prof. P. Carloni
INTRODUZIONE ALLA STECHIOMETRIA
La materia tutta è costituita da varie combinazioni di forme semplici definite elementi
chimici. La materia si trasforma attraverso la combinazione di più sostanze in quella che
viene definita reazione chimica. La stechiometria non è altro che quella branca della
chimica che studia le relazioni quantitative che si realizzano nei processi chimici.
I COMPOSTI
Prima di descrivere i vari tipi di composti inorganici e la loro nomenclatura è necessario
approfondire un concetto che abbiamo già accennato durante lo studio del legame
chimico, quello di valenza. La valenza è un numero che ci indica il rapporto di
combinazione dei vari elementi e più precisamente indica con quanti atomi di un elemento
di valenza unitaria un certo elemento si può combinare. L'atomo con valenza unitaria per
eccellenza è l'idrogeno in quanto ha un solo elettrone e gli manca un solo elettrone per
raggiungere la completezza del guscio di valenza: ad esso verrà quindi attribuita sempre
valenza 1.
Facciamo degli esempi.
Consideriamo la molecola dell'acqua, H2O: l'idrogeno ha sempre valenza unitaria, per cui
l'ossigeno poiché si combina con due atomi di idrogeno ha in questi caso valenza 2.
HCl:
H = valenza 1
Cl = valenza 1
FeO:
O = valenza 2
Fe = valenza 2
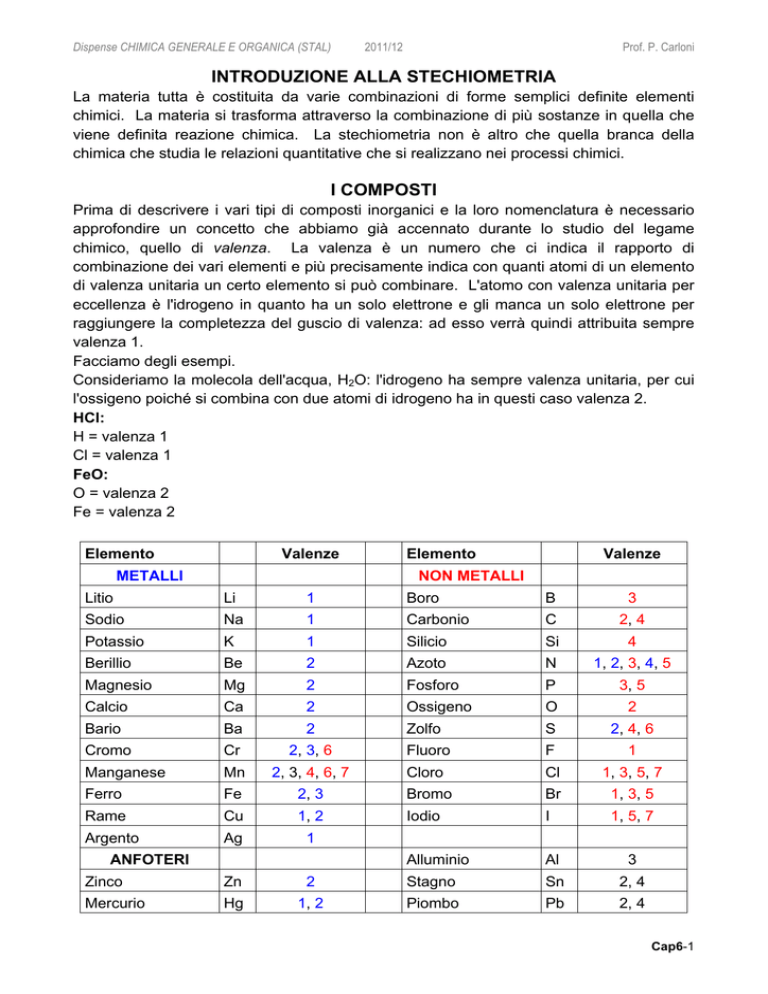
Elemento
Valenze
METALLI
Elemento
Valenze
NON METALLI
Litio
Li
1
Boro
B
3
Sodio
Na
1
Carbonio
C
2, 4
Potassio
K
1
Silicio
Si
4
Berillio
Be
2
Azoto
N
1, 2, 3, 4, 5
Magnesio
Mg
2
Fosforo
P
3, 5
Calcio
Ca
2
Ossigeno
O
2
Bario
Ba
2
Zolfo
S
2, 4, 6
Cromo
Cr
2, 3, 6
Fluoro
F
1
Manganese
Mn
2, 3, 4, 6, 7
Cloro
Cl
1, 3, 5, 7
Ferro
Fe
2, 3
Bromo
Br
1, 3, 5
Rame
Cu
1, 2
Iodio
I
1, 5, 7
Argento
Ag
1
Alluminio
Al
3
ANFOTERI
Zinco
Zn
2
Stagno
Sn
2, 4
Mercurio
Hg
1, 2
Piombo
Pb
2, 4
Cap6-1
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2010/11
Prof. P. Carloni
Esistono elementi che si possono combinare in modi diversi e quindi possiedono diverse
valenze a seconda del composto che formano, mentre altri hanno in tutti i composti la
stessa valenza. Tale valenza dipende dalla configurazione dell'elemento e per gli
elementi dei primi e degli ultimi gruppi corrisponde spesso al numero di elettroni contenuti
nel guscio di valenza (per i metalli dei primi gruppi) o al numero di elettroni che mancano
all'elemento per completare il guscio di valenza (per i non metalli degli ultimi gruppi).
Possiamo stilare una tabella con le valenze degli elementi più comuni, suddivisi in metalli,
non metalli e anfoteri.
Una volta chiarito il concetto di valenza e stabilite le valenze degli elementi principali
possiamo cominciare a studiare i vari tipi di composti inorganici e analizzare la loro
nomenclatura.
Ossidi
Tutti gli elementi formano composti binari (formati da due elementi) con l'ossigeno che si
chiamano ossidi.
I metalli formano ossidi con caratteristiche basiche, mentre i non metalli formano ossidi
con caratteristiche acide che vengono anche chiamati anidridi.
Per scrivere la formula di un ossido si scrive prima il simbolo dell'elemento che si lega con
l'ossigeno e quindi l'ossigeno. Si mette poi in pedice all'elemento la valenza dell'ossigeno
(II) e in pedice all'ossigeno la valenza dell'elemento. Se i due pedici sono semplificabili, si
semplifica e il numero 1 non si riporta.
OSSIDO
(Elemento + Ossigeno)
Ossido acido o
Anidride
(Non Metallo + Ossigeno)
Ossido basico
(Metallo + Ossigeno)
Per quanto riguarda la nomenclatura sistematica, essi vengono chiamati tutti ossidi
dell'elemento anche se per gli ossidi acidi è ancora in uso la vecchia nomenclatura di
anidride. Se l'elemento che si combina con l'ossigeno ha due valenze, si aggiunge il
suffisso -oso all'ossido dell'elemento con la valenza inferiore ed il suffisso -ico all'ossido
dell'elemento con la valenza superiore.
OSSIDI BASICI
K (I)
O (II)
Ca (II)
O (II)
Fe (II)
O (II)
Fe (III)
O (II)
OSSIDI ACIDI
C (II)
O (II)
Cap6-2
Ì
Ì
Ì
Ì
K2O1
Ca2O2
Fe2O2
Fe2O3
=
=
=
K2O
CaO
FeO
Ossido di potassio
Ossido di calcio
Ossido ferroso
Ossido ferrico
Ì
C2O2
=
CO
Ossido di carbonio
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2011/12
Prof. P. Carloni
C (IV)
O (II)
Ì
C2O4
=
CO2
Anidride carbonica
Ì
S2O4
=
SO2
Ossido solforoso
S (IV)
O (II)
S (VI)
O (II)
Ì
S2O6
=
SO3
Ossido solforico
Se le valenze sono quattro come nel caso del Cloro si usano sia prefissi che suffissi e più
precisamente:
Cl (I)
O (II)
Ì
Cl2O1
=
Cl2O
Anidride ipoclorosa
Cl (III)
O (II)
Ì
Cl2O3
Anidride clorosa
Cl (V)
O (II)
Ì
Cl2O5
Anidride clorica
Cl (VII)
O (II)
Ì
Cl2O7
Anidride perclorica
Per alcuni composti esiste anche una nomenclatura comune che specifica semplicemente
il numero di atomi di ossigeno contenuti nella molecola, o dà ad alcuni composti nomi
convenzionali.
Pb (IV)
O (II)
Ì
Pb2O4
=
PbO2
Biossido di piombo
Ì
V2O5
Pentossido di vanadio
V (V)
O (II)
Os (VIII) O (II)
Ì
Os2O8
=
OsO4
Tetrossido di osmio
Fe (III)
O (II)
Ì
Fe2O3
Sesquiossido di ferro (2:3)
N (I)
O (II)
Ì
N2O
Protossido di azoto
H (I)
O (II)
Ì
H2O
Acqua
Infine esiste anche un tipo di nomenclatura chiamata IUPAC che è la nomenclatura
ufficialmente riconosciuta nel mondo scientifico e che classifica sistematicamente tutti i tipi
di composti. Per quanto riguarda i composti inorganici però, questo tipo di nomenclatura
non viene comunemente usata. Essa comunque prevede che per denominare un ossido
si scriva la parola ossido preceduta da un prefisso che indica il numero di atomi di
ossigeno che lo compongono e quindi il nome dell'elemento preceduto anch'esso da un
simile prefisso.
N (I)
O (II)
Ì
N2O
Ossido di diazoto
Cl (V)
O (II)
Ì
Cl2O5
Pentaossido di dicloro
C (IV)
O (II)
Ì
C2O4
=
CO2
Diossido di carbonio
Perossidi
Sono composti dei metalli con l'ossigeno dove sono presenti sempre due atomi di
ossigeno legati fra loro. All'ossigeno rimane quindi solo una valenza per legare gli atomi
del metallo: l'ossigeno in questi composti ha quindi velenza I. Sono pochi.
Per scrivere la formula di un Perossido si scrive prima il metallo e quindi l'ossigeno. Si
mette poi in pedice al metallo la valenza dell'ossigeno (I) e in pedice all'ossigeno la
valenza del metallo. Gli atomi di ossigeno devono essere almeno due, se non lo sono, si
moltiplica per due.
K (I)
O (I)
Ì
K1O1 = K2O2
Perossido di potassio
Na (I)
O (I)
Ì
Na1O1 = Na2O2
Perossido di sodio
Ba (II) O (I)
Ì
Ba1O2 = BaO2
Perossido di bario
H (I)
O (I)
Ì
H1O1 = H2O2
Perossido di idrogeno o acqua ossigenata
Idrossidi o Idrati basici
Facendo interagire un Ossido Basico con l'acqua si forma un Idrossido.
Cap6-3
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2010/11
Prof. P. Carloni
Un idrossido è un composto ternario formato da un Metallo, Ossigeno e Idrogeno. La
formula di un Idrossido è formata da un atomo del Metallo seguito da tanti gruppi OH
quanti ne indica la valenza del metallo stesso.
K (I)
Ca (II)
Fe (II)
Fe (III)
Ì
Ì
Ì
Ì
K(OH)1
Ca(OH)2
Fe(OH)2
Fe(OH)3
=
KOH
Idrossido di potassio
Idrossido di calcio
Idrossido ferroso
Idrossido ferrico
Per quanto riguarda la nomenclatura sistematica si usano gli stessi suffissi usati per gli
ossidi. La nomenclatura IUPAC chiama tali composti Idrati Basici e aggiunge il nome del
metallo con indicata la sua valenza in numero romano tra parentesi.
Na (I)
Mg (II)
Pb (IV)
Al (III)
Ì
Ì
Ì
Ì
Na(OH)1
Mg(OH)2
Pb(OH)4
Al(OH)3
=
NaOH
Idrato basico di sodio(I)
Idrato basico di magnesio(II)
Idrato basico di piombo(IV)
Idrato basico di alluminio(III)
Gli idrossidi possono perdere gruppi OH* per formare gli ioni metallici positivi (cationi) che
sono costituenti essenziali dei sali (che vedremo in seguito).
KOH
Ca(OH)2
Fe(OH)2
Fe(OH)3
NaOH
Mg(OH)2
Pb(OH)4
Al(OH)3
Ì
Ì
Ì
Ì
Ì
Ì
Ì
Ì
K)
Ca)2
Fe)2
Fe)3
Na)
Mg)2
Pb)4
Al)3
Ione potassio
Ione calcio
Ione ferroso
Ione ferrico
Ione sodio
Ione magnesio
Ione piombico o ione piombo(IV)
Ione alluminio
Ossiacidi o Idrati Acidi
Facendo interagire un Ossido Acido con l'acqua si forma un Ossiacido.
Un ossiacido è un composto ternario formato da un Non Metallo, Ossigeno e Idrogeno. La
formula di un Ossiacido è formata da atomi di Idrogeno, atomi di Non Metallo e atomi di
Ossigeno in questa sequenza. Il numero di questi atomi si ricava dalla somma degli atomi
contenuti in una molecola di ossido acido (anidride) più quelli contenuti in una molecola di
acqua. Se i pedici sono semplificabili, si semplificano.
CO2 +
H2O
Ì
H2CO3
Acido carbonico
Cl2O +
H2O
Ì
H2Cl2O2
=
HClO
Acido ipocloroso
Cl2O3 +
H2O
Ì
H2Cl2O4
=
HClO2
Acido cloroso
Cl2O5 +
H2O
Ì
H2Cl2O6
=
HClO3
Acido clorico
Cl2O7 +
H2O
Ì
H2Cl2O8
=
HClO4
Acido perclorico
Cap6-4
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2011/12
Prof. P. Carloni
SO2 +
H2O
Ì
H2SO3
Acido solforoso
H2O
Ì
H2SO4
Acido solforico
SO3 +
Per quanto riguarda la nomenclatura sistematica si usano gli stessi suffissi e prefissi usati
per gli ossidi.
La nomenclatura IUPAC chiama tali composti Acidi di
Ossoelemento(Valenza).
N2O3 +
H2O
Ì
H2N2O4
=
HNO2
Acido di ossoazoto(III)
N2O5 +
H2O
Ì
H2N2O6
=
HNO3
Acido di ossoazoto(V)
)
Gli ossiacidi possono perdere ioni H per formare gli ioni poliatomici negativi (anioni) che
sono costituenti essenziali dei sali (che vedremo in seguito).
Ossido
Ossido Basico
Ossido Acido
Acqua
Ossiacido
ANIONI POLIATOMICI
Gli acidi con suffisso -oso danno origine a ioni con suffisso -ito; acido con suffisso -ico
danno origine a ioni con suffisso -ato.
-oso
-ico
Ì
Ì
-ito
-ato
HNO2
Ì
NO2*
Ione nitrito
*
Ì
NO3
Ione nitrato
HNO3
*
HClO3
Ì
ClO3
Ione clorato
*
HClO4
Ì
ClO4
Ione perclorato
Se gli acidi contengono più di un atomo di idrogeno e non tutti gli atomi di idrogeno
vengono persi si aggiunge la parola acido o il prefisso bi- o il prefisso idrogeno-.
H2CO3
Ì HCO3* Ione carbonato acido o bicarbonato o idrogenocarbonato
Ì CO3*2 Ione carbonato
H2CO3
H2SO4
Ì HSO4* Ione solfato acido o bisolfato o idrogenosolfato
H2SO4
Ì SO4*2
Ione solfato
Composti binari con l'idrogeno.
Molti elementi danno origine anche a composti binari con l'idrogeno che possono avere
caratteristiche acide, basiche o anfotere.
Cap6-5
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2010/11
Prof. P. Carloni
COMPOSTI BINARI CON IDROGENO
Idruri
(M + H)
Idracidi
(H + NM)
Anfoteri
(Vari + H)
Idracidi
Gli alogeni e lo zolfo, nella loro valenza più bassa, formano composti binari con l'idrogeno
con caratteristiche acide che si chiamano idracidi.
Per scrivere la formula di un idracido si scrive prima il simbolo dell'idrogeno e quindi quello
dell'elemento. Si mette poi, come per gli ossidi, in pedice all'idrogeno la valenza
dell'elemento e in pedice all'elemento la valenza dell'idrogeno (I). Il numero 1 non si
riporta.
H (I)
F (I)
Ì
HF
Acido Fluoridrico
Ì
HCl
Acido Cloridrico
H (I)
Cl (I)
H (I)
Br (I)
Ì
HBr
Acido Bromidrico
H (I)
I (I)
Ì
HI
Acido Iodidrico
Ì
H2S
Acido Solfidrico
H (I)
S (II)
Per quanto riguarda la nomenclatura sistematica, essi vengono detti acidi dell'elemento
con il pedice -idrico.
Come gli ossiacidi essi possono perdere ioni H) per formare ioni negativi (anioni) che sono
costituenti essenziali dei sali (che vedremo in seguito).
COMPOSTI BINARI CON IDROGENO
Idruri
(M + H)
Idracidi
(H + NM)
Anfoteri
(Vari + H)
Anioni
Gli idracidi danno origine a ioni con suffisso -uro.
HF
HCl
HBr
HI
Ì
Ì
Ì
Ì
F*
Cl*
Br*
I*
Ione fluoruro
Ione cloruro
Ione bromuro
Ione ioduro
Se gli acidi contengono più di un atomo di idrogeno e non tutti gli atomi di idrogeno
vengono persi si aggiunge la parola acido o il prefisso bi- o il prefisso idrogeno-.
Cap6-6
Dispense CHIMICA GENERALE E ORGANICA (STAL)
H2S
H2S
Ì
Ì
HS*
S*2
2011/12
Prof. P. Carloni
Ione solfuro acido o bisolfuro o idrogenosolfuro
Ione solfuro
Idruri
I metalli formano composti binari con l'idrogeno con caratteristiche basiche che si
chiamano idruri. Per scrivere la formula di un idruro si scrive prima il simbolo del metallo e
quindi quello dell'idrogeno. Si mette poi, come per gli ossidi, in pedice al metallo la
valenza dell'idrogeno e in pedice all'idrogeno la valenza del metallo. Il numero 1 non si
riporta.
Ì
NaH
Idruro di sodio
Na (I)
H (I)
Ì
LiH
Idruro di litio
Li (I)
H (I)
Ì
BH3
Idruro di boro
B (III)
H (I)
Ì
AlH3
Idruro di alluminio
Al (III)
H (I)
Per quanto riguarda la nomenclatura sistematica, essi vengono detti idruri del metallo.
I metalli possono formare anche idruri misti formati da due metalli e l'idrogeno. In questo
caso, per scrivere la formula, si mettono prima i simboli dei metalli e quindi quello
dell'idrogeno. Si mette poi, in pedice all’idrogeno la somma delle valenze dei metalli.
Na (I)
Li (I)
B (III)
Al (III)
H (I)
H (I)
Ì
Ì
NaBH4
LiAlH4
Idruro di sodio e boro
Idruro di litio e alluminio
Composti Binari con l'idrogeno Vari
Alcuni elementi formano composti binari con l'idrogeno con caratteristiche anfotere che
hanno nomi comuni. I più comuni sono:
Ì
H2O
Acqua
H (I)
O (II)
Ì
NH3
Ammoniaca
N (III)
H (I)
P (III)
H (I)
Ì
PH3
Fosfina
Essi possono sia perdere che acquistare ioni H) per formare ioni.
H2O (-H))
Ì
OH*
Ione ossidrile
)
)
Ì
H3O
Ione ossonio o idrossonio
H2O (+H )
)
*
Ì
NH2
Ione ammide
NH3 (-H )
)
)
Ì
NH4
Ione ammonio
NH3 (+H )
)
)
PH3 (+H )
Ì
PH4
Ione fosfonio
Sali
I sali sono composti formati da uno ione positivo (derivante nella maggior parte dei casi da
un metallo) ed uno ione negativo (derivante nella maggior parte dei casi da un non
metallo).
Per scrivere la formula di un sale si scrive prima lo ione positivo e quindi lo ione negativo
senza le loro cariche. Si mette poi in pedice allo ione positivo (raggruppato da una
parentesi) la carica dello ione negativo senza segno e in pedice allo ione negativo
(raggruppato da una parentesi) la carica dello ione positivo senza segno. Se i due pedici
sono semplificabili, si semplificano, il numero 1 e le parentesi senza pedice non si
Cap6-7
Dispense CHIMICA GENERALE E ORGANICA (STAL)
riportano.
Ca)2
NO3*
Ì
2010/11
Ca1(NO3)2
Prof. P. Carloni
= Ca(NO3)2
Nitrato di Calcio
Per quanto riguarda la nomenclatura sistematica, si scrive semplicemente prima il nome
dell'anione e poi quello del catione.
CATIONI
KOH
Ca(OH)2
Fe(OH)2
Fe(OH)3
NaOH
Mg(OH)2
Pb(OH)4
Al(OH)3
NH3
PH3
ANIONI
HNO2
HNO3
HClO3
HClO4
H2CO3
H2CO3
H2SO4
H2SO4
HF
HCl
HBr
HI
H2S
H2S
ESEMPI
Fe)2
Na)
Fe)3
Fe)2
NH4)
Na)
Ì
Ì
Ì
Ì
Ì
Ì
Ì
Ì
Ì
Ì
K)
Ca)2
Fe)2
Fe)3
Na)
Mg)2
Pb)4
Al)3
NH4)
PH4)
Ì
Ì
Ì
Ì
Ì
Ì
Ì
Ì
Ì
Ì
Ì
Ì
Ì
Ì
NO2*
NO3*
ClO3*
ClO4*
HCO3*
CO3*2
HSO4*
SO4*2
F*
Cl*
Br*
I*
HS*
S*2
NO2*
ClO*
SO4*2
Cl*
S*2
HCO3*
Ì
Ì
Ì
Ì
Ì
Ì
Fe1(NO2)2
Na1(ClO)1
Fe2(SO4)3
Fe1Cl2
(NH4)2(S)1
Na1(HCO3)1
Ione potassio
Ione calcio
Ione ferroso
Ione ferrico
Ione sodio
Ione magnesio
Ione piombico o ione piombo(IV)
Ione alluminio
Ione ammonio
Ione fosfonio
Ione nitrito
Ione nitrato
Ione clorato
Ione perclorato
Ione carbonato acido o bicarbonato
Ione carbonato
Ione solfato acido o bisolfato
Ione solfato
Ione fluoruro
Ione cloruro
Ione bromuro
Ione ioduro
Ione solfuro acido o bisolfuro
Ione solfuro
= Fe(NO2)2
= NaClO
= FeCl2
= (NH4)2S
= NaHCO3
Nitrito Ferroso
Ipoclorito di Sodio
Solfato Ferrico
Cloruro Ferroso
Solfuro di Ammonio
Bicarbonato di Sodio
Composti di Coordinazione
I composti di coordinazione sono composti formati da gruppi contenenti atomi che
possiedono dei doppietti elettronici disponibili o ioni negativi (donatori), legati a gruppi che
possiedono delle lacune elettroniche o a ioni positivi (accettori), attraverso legami dativi o
Cap6-8
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2011/12
Prof. P. Carloni
di coordinazione. I più comuni donatori che possono essere denominati anche leganti
sono, gli alogenuri (X-), l’atomo di ossigeno nello ione idrossido (OH-) e nella molecola
dell’acqua (H2O), l’azoto dell’ammoniaca (NH3) e dei suoi derivati (ammine), e gli atomi di
fosforo e di arsenico in composti come PF3 o AsCl3. Gli accettori più comuni sono gli ioni
dei metalli, gli elementi del III gruppo come boro (B), alluminio (Al) e gallio (Ga) quando
sono presenti in molecole nelle quali non raggiungono gli otto elettroni nel livello più
esterno (p.es. BCl3, AlF3, GaCl3) e lo ione H+ in quanto non possiede un atmosfera
elettronica (protone). Il numero di coordinazione è il numero di legami dativi che forma
l’accettore nel formare un composto di coordinazione. Nella maggior parte dei complessi
di metalli il numero di coordinazione è un numero pari, generalmente 2,4,6 e, più
raramente, 8, 10 e 12; si conoscono però anche complessi con numeri di coordinazione
dispari come 5 (è il più frequente), 7 e 9. In generale, quando un dato atomo o ione
metallico si unisce con un certo tipo di legante, il complesso che ne deriva presenterà un
suo caratteristico numero di coordinazione dovuto, soprattutto, al metallo centrale.
La formula dei composti di coordinazione viene solitamente scritta tra parentesi quadre,
con la carica elettrica scritta come se fosse un esponente, quando si tratta di uno ione.
Nelle formule si scrive prima l’elemento centrale e poi i leganti con carica negativa, seguiti
da quelli neutri e, infine, i leganti con carica positiva.
Per leganti anionici inorganici o organici il nome non cambia, a eccezione di alcuni , che
vengono abbreviati, come per esempio: F- (fluoro anziché fluoruro); Cl- (cloro anziché
cloruro); Br- (bromo anziché bromuro); I- (iodo anziché ioduro); OH- (idrosso anziché
ossidrile); S2- (tio anziché solfuro); CN- (ciano anziché cianuro); l’acqua viene chiamata
aquo; l’ammoniaca ammino; NO è detto nitrosil, CO carbonil, CS tiocarbonil.
Per assegnare il nome al complesso si leggono prima i leganti preceduti dai prefissi greci
di, tri , tetra, … che ne indicano il numero. Se sono presenti leganti differenti nello stesso
complesso si indicano in ordine alfabetico (per l’ordine alfabetico non contano gli
eventuali prefissi). Il nome del metallo centrale compare per ultimo seguito dalla valenza
tra parentesi in numero romano. Se il complesso è carico positivamente o neutro il nome
dell’atomo centrale rimane immutato. Se è carico negativamente dell’atomo viene
assegnato il suffisso -ato.
Complessi anionici:
[Fe(CN)6]3esacianoferrato(III) o ferricianuro;
[CrCl4(H2O)2] diaquotetraclorocromato(III);
esacianoferrato(II) o ferrocianuro
[Fe(CN)6]43[Co(SCN)6]
esatiocianocobaltato(III)
Complessi cationici:
[Cu(NH3)4]2+
tetramminorame(II)
+
[Ag(NH3)2]
diamminoargento(I)
2+
tetraaquoberillio(II)
[Be(H2O)4]
+
[CoCl2(NH3)4] tetraamminodiclorocobalto(III)
Complessi neutri:
[Ni(CO)4]
tetracarbonilnichel(0)
[PtCl4(NH3)2] diamminoteracloroplatino(IV)
[PtCl2en]
dicloroetilendiamminoplatino(II)
(“en” indica l’etilendiammina, NH2CH2CH2NH2)
Cap6-9
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2010/11
Prof. P. Carloni
Dalla formula al nome
Fino a qui abbiamo classificato i tipi più comuni di composti inorganici, abbiamo imparato a
scrivere le loro formule ed abbiamo assegnato ad essi un nome sulla base della valenza
(o numero di ossidazione) che essi assumevano in un determinato composto. E’possibile
però che ci capiti di dover dare il nome ad un composto di cui conosciamo solamente la
formula.
Per fare questo risulta molto utile introdurre il concetto di numero di ossidazione che in
modo analogo alla valenza ci indica come un elemento si lega in un determinato composto
ed è molto utile per trovare il nome di un composto a partire dalla sua formula (servirà
anche a capire lo svolgimento di alcune reazioni). Il numero di ossidazione equivale in
valore numerico alla valenza ma può essere negativo o positivo in quanto rappresenta la
carica limite che un atomo presenterebbe qualora acquistasse o cedesse definitivamente
gli elettroni condivisi nei legami e rappresenta quindi il numero di elettroni che possono
essere attribuiti ad un elemento che forma un determinato composto, in più o in meno
rispetto all’elemento nello stato fondamentale. L’attribuzione degli elettroni viene fatta
assegnando gli elettroni che caratterizzano ogni legame covalente all’atomo più
elettronegativo o, nel caso che i due atomi legati siano uguali, uno ad ognuno degli atomi.
Ad esempio nella molecola H2CO3 (acido carbonico), che presenta un atomo di carbonio
centrale legato ai tre atomi di ossigeno e i due atomi di idrogeno legati a due degli atomi di
ossigeno sia gli elettroni dei legami carbonio-ossigeno che quelli dei legami idrogenoossigeno vengono attribuiti all’ossigeno in quanto l’ossigeno è più elettronegativo sia del
carbonio che dell’idrogeno: ne consegue che ogni atomo di ossigeno avrà 8 elettroni di
valenza e cioè 2 in più rispetto allo stato fondamentale, l’atomo di carbonio 0 elettroni di
valenza e cioè 4 in meno rispetto allo stato fondamentale e gli atomi di idrogeno 0 elettroni
di valenza e cioè 1 in meno rispetto allo stato fondamentale.
H
H
O
O
H C H
C O O
O O
Per ogni elettrone in più si segna un –1, e per ogni elettrone in meno un +1: gli atomi di
ossigeno avranno quindi numero di ossidazione –2, l’atomo di carbonio +4 e gli atomi di
idrogeno +1.
I numeri di ossidazione che i diversi elementi possono avere nei diversi composti sono
riportati nella tavola periodica. In calce si riporta uno schema dove vengono riportati gli
elementi più comuni con i rispettivi numeri di ossidazione. I numeri di ossidazione
coincidono con le valenze nel valore numerico; le valenze di solito si indicano con un
numero romano.
Esistono inoltre delle regole che permettono di assegnare in modo semplice i numeri di
ossidazione agli elementi nei composti e che sono utili soprattutto per quegli elementi che
possono presentare più di uno stato di ossidazione.
- Le sostanze allo stato fondamentale hanno tutte N.O. = 0
- Gli ioni monoatomici hanno tutti N.O. = carica
- L’idrogeno ha nei composti sempre N.O. = +1 tranne negli idruri dove ha N.O. = -1
- L’ossigeno ha nei composti sempre N.O. = -2 tranne nei perossidi dove ha N.O. = -1
Cap6-10
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2011/12
Prof. P. Carloni
- I metalli alcalini hanno sempre N.O. = +1
- I metalli alcalino-terrosi hanno sempre N.O. = +2
- La somma dei N.O. in una molecola neutra è sempre = 0
- La somma dei N.O. in uno ione è sempre = carica
- Per i sali è conveniente trovare gli ioni che li compongono prima di determinare i N.O.
Ad esempio:
H = +1
O = -2
H2SO4
2xH+S+4xO=0
2 x (+ 1) + (S) + 4 x (-2) = 0
S = –2 x (+1) -4 x (-2) = +6
K+ e Cr2O7-2
K = +1
O = -2
K2Cr2O7
2 x Cr + 7 x O = -2
2 x Cr + 7 x (-2) = -2
Cr = [-2 -7 x (-2)] / 2 = +6
O = -2
1 x N + 3 x O = -1
NO3*
1 x N + 3 x (-2) = -1
N = -3 x (-2) –1 = +5
Una volta stabilito il numero di ossidazione dei diversi elementi nei diversi composti per
assegnare loro il nome dobbiamo quindi:
determinare che tipo di composto abbiamo davanti, dalla sequenza di atomi
stabilire se gli atomi sono nel loro stato di ossidazione minore o maggiore
determinare di conseguenza la desinenza dei nomi
costruire il nome
Esempi:
HNO3 ⇒ ossiacido ⇒ H = +1; O = -2; N = -1 x (+1) –3 x (-2) = +5 ⇒ stato di ossidazione
maggiore tra 3 e 5 ⇒ acido nitrico
FeCl2 ⇒ sale ⇒ Fe2+ = +2 e Cl- = -1 ⇒ per il Fe stato di ossidazione minore, l’anione
deriva da un idracido ⇒ cloruro ferroso
HCl ⇒ idracido ⇒ acido cloridrico
NO ⇒ ossido ⇒ O = -2; N = +2 ⇒ nome comune ⇒ ossido di azoto
FeCl3 ⇒ sale ⇒ Fe3+ = +3 e Cl- = -1 ⇒ per il Fe stato di ossidazione maggiore, l’anione
deriva da un idracido ⇒ cloruro ferrico
H2O ⇒ ossido ⇒ H = +1; O = -2 ⇒ nome comune ⇒ acqua
KMnO4 ⇒ sale ⇒ K+ = +1 e MnO4- ⇒ O = -2; Mn = -1 -4 x (-2) = +7 ⇒ per il Mn satato di
ossidazione maggiore tra 4, 6 e 7 ⇒ permanganato di potassio
KBr ⇒ K+ = +1; Br- = -1 ⇒ bromuro di potassio
MnO2 ⇒ O = -2; Mn = -2 x (-2) = +4 ⇒ biossido di manganese
KBrO3 ⇒ K+ = +1 e BrO3-; O = -2; Br = -1 -3 x (-2) = +5 ⇒ bromato di potassio
FeSO4 ⇒ Fe2+ = +2 e SO42-; O = -2; S = -2 -4 x (-2) = +6 ⇒ solfato ferroso
H2SO4 ⇒ H = +1; O = -2; S = -2 x (+1) -4 x (-2) = +6 ⇒ acido solforico
MnSO4 ⇒ Mn+2 = +2 e SO42-; O = -2; S = -2 -4 x (-2) = +6 ⇒ solfato di manganese (II)
Fe2(SO4)3 ⇒ Fe3+ = +3 e SO42-; O = -2; S = -2 -4 x (-2) = +6 ⇒ solfato ferrico
Cap6-11
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2010/11
Prof. P. Carloni
K2SO4 ⇒ K+ = +1 e SO42-; O = -2; S = -2 -4 x (-2) = +6 ⇒ solfato di potassio
Particolarità di alcuni elementi
CARBONIO
Il carbonio ha come simbolo C e può avere due valenze nelle quali si comporta in modo
diverso.
Nella valenza 2 forma solamente l'ossido.
C2O2
=
CO
Ossido di carbonio
C (II)
O (II) Ì
Nella valenza 4 si comporta normalmente da Non Metallo e forma quindi l'Anidride e
l'Ossiacido con la desinenza -ico.
C2O4
= CO2
Anidride o ossido Carbonica
C (IV) O (II) Ì
H2CO3
Acido Carbonico
CO2 + H2O Ì
L'acido carbonico ha due atomi di idrogeno e può quindi dare origine a due diversi anioni:
H2CO3 Ì
HCO3* Ione carbonato acido o bicarbonato o idrogenocarbonato
CO3*2 Ione carbonato
H2CO3 Ì
AZOTO
L'azoto ha come simbolo N e può avere cinque valenze nelle quali si comporta però in
modo diverso.
Nelle valenze 1, 2 e 4 forma solamente gli ossidi che portano dei nomi comuni.
OSSIDI
N (I)
O (II) Ì
N2O1
=
N2O
Protossido di azoto
N2O2
=
NO
Ossido di azoto
N (II)
O (II) Ì
N2O4
=
NO2
Biossido di azoto
N (IV)
O (II) Ì
Nelle valenze 3 e 5 si comporta normalmente da Non Metallo e forma quindi le Anidridi e
gli Ossiacidi con le desinenze -oso e -ico.
ANIDRIDI
N2O3
Anidride o ossido Nitrosa
N (III) O (II) Ì
N (V) O (II) Ì
N2O5
Anidride o ossido Nitrica
OSSIACIDI
N2O3 + H2O Ì H2N2O4 =
HNO2
Acido Nitroso
N2O5 + H2O Ì H2N2O6 =
HNO3
Acido Nitrico
che possono dare origine ai due anioni corrispondenti:
HNO2
Ì
NO2*
Ione nitrito
*
HNO3
Ì
NO3
Ione nitrato
L'azoto forma anche altri composti:
N (III) H (I)
Ì
NH3
Ammoniaca
)
*
NH3 (-H )
Ì
NH2
Ione ammide
)
)
Ì
NH4
Ione ammonio
NH3 (+H )
FOSFORO
Il fosforo ha come simbolo P e può avere due valenze nelle quali si comporta da Non
Metallo e forma quindi normalmente le Anidridi.
P (III) O (II) Ì
P2O3
Anidride o ossido Fosforosa
Cap6-12
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2011/12
Prof. P. Carloni
P (V) O (II) Ì
P2O5
Anidride o ossido Fosforica
La sua particolarità principale sta nella formazione degli ossiacidi. Esso infatti per ognuna
delle due valenze può formare tre diversi ossiacidi addizionando 1, 2 o 3 molecole di
acqua.
H2O
Ì H2P2O4 = HPO2
Acido Metafosforoso
P2O3 +
2H2O Ì
H4P2O5
Acido Pirofosforoso
P2O3 +
3H2O Ì H6P2O6 = H3PO3
Acido Ortofosforoso o fosforoso
P2O3 +
P2O5 +
H2O
Ì H2P2O6 = HPO3
Acido Metafosforico
2H2O Ì
H4P2O7
Acido Pirofosforico
P2O5 +
P2O5 +
3H2O Ì H6P2O8 = H3PO4
Acido Ortofosforico o fosforico
Sia l’acido fosforoso che quello fosforico hanno tre atomi di idrogeno e possono quindi
dare origine a tre diversi anioni:
H2PO4* Ione fosfato biacido o diidrogenofosfato
H3PO4 Ì
HPO4*2 Ione fosfato acido o idrogenofosfato
H2PO4* Ì
HPO4*2 Ì
PO4*3
Ione fosfato
Il fosforo forma inoltre anche altri composti:
Ì
PH3
Fosfina
P (III) H (I)
)
)
Ì
PH4
Ione fosfonio
PH3 (+H )
(HPO3)n
Acido polifosforico
ZOLFO
Lo zolfo ha come simbolo S e può avere tre valenze nelle quali si comporta però in modo
diverso.
Nella valenza 2 forma solamente l'idracido:
Ì
H2S
Acido Solfidrico
H (I)
S (II)
che può dare origine a due anioni:
Ì
HS*
Ione solfuro acido o bisolfuro
H2S
*2
Ì
S
Ione solfuro
H2S
Nelle valenze 4 e 6 si comporta normalmente da Non Metallo e forma quindi le Anidridi e
gli Ossiacidi con le desinenze -oso e -ico.
ANIDRIDI
S (IV) O (II) Ì
S2O4
=
SO2
Anidride o ossido Solforosa
S2O6
=
SO3
Anidride o ossido Solforica
S (VI) O (II) Ì
OSSIACIDI
Acido Solforoso
SO2 + H2O Ì H2SO3
SO3 + H2O Ì H2SO4
Acido Solforico
che possono dare origine, ognuno, a due anioni:
H2SO3
Ì
HSO3*
Ione solfito acido o bisolfito o idrogenosolfito
*2
H2SO3
Ì
SO3
Ione solfito
*
Ì
HSO4
Ione solfato acido o bisolfato o idrogenosolfato
H2SO4
*2
H2SO4
Ì
SO4
Ione solfato
CROMO
Il cromo ha come simbolo Cr e può avere diverse valenze nelle quali si comporta però in
modo diverso.
Nella valenza 2 si comporta da metallo e forma l’ossido cromoso CrO e l’idrossido
Cap6-13
Dispense CHIMICA GENERALE E ORGANICA (STAL)
2010/11
Prof. P. Carloni
cromoso Cr(OH)2; nella valenza 3 si comporta da metallo e forma l’ossido cromico Cr2O3
e l’idrossido cromico Cr(OH)3; nella valenza 6 si comporta da non metallo e forma
l’anidride cromica CrO3 e l’acido cromico H2CrO4; inoltre l’anidride cromica in ambiente
acido si può combinare in modo particolare con l’acqua (due molecole di anidride con una
di acqua) per dare l’acido dicromico H2Cr2O7; entrambi questi ossiacidi possono
dissociare per dare i rispettivi anioni che sono il cromato (CrO42-) giallo, stabile in
soluzione alcalina ed il dicromato (Cr2O72-) arancione, stabile in soluzione acida che è un
forte ossidante..
MANGANESE
Il Manganese ha come simbolo Mn e può avere anch’esso diverse valenze nelle quali si
comporta però in modo diverso.
Nella valenza 2 si comporta da metallo e forma l’ossido manganoso MnO e l’idrossido
manganoso Mn(OH)2; nella valenza 3 ha un comportamento anfotero e forma l’ossido
manganico o triossido di dimanganese Mn2O3 (poco comune); nella valenza 4 ha un
comportamento non metallico e forma l’anidride o ossido manganoso MnO2 detto più
comunemente biossido di manganese; nella valenza 6 si comporta da non metallo e
forma l’anidride manganica MnO3 e l’acido manganico H2MnO4; infine nella valenza 7 si
comporta ancora da non metallo e forma l’anidride permanganica Mn2O7 e l’acido
permanganico HMnO4; entrambi questi ossiacidi possono dissociare per dare i rispettivi
anioni che sono il manganato (MnO42-) ed il permanganato (MnO4-) violetto che è un forte
ossidante.
Cap6-14