L’ Indice Glicemico (IG) è l’incremento di glucosio nel sangue determinato dalla assunzione di un dato alimento; esso viene valutato in base ad una scala, i cui i valori sono compresi tra 0 e 100 (il valore 100 è a?ribuito al pane bianco) Valori di IG • compresi tra 70 e 100 sono consideraA alA • tra 55 e 70 sono consideraA medi • inferiore a 55 sono consideraA bassi L’indice glicemico
Dopo il Consumo di carboidrati si ha:
Dapprima un
aumento della concentrazione di zuccheri nel sangue
E successivamente una
diminuzione
Risposta glicemica
Tale risposta si traduce in un valore e dipende da: Alimento, tipo di zucchero,
natura e forma dell’amido, i metodi di cottura e di lavorazione industriale utilizzati,
Metabolismo, momento della giornata in cui viene ingerito il carboidrato.
Questa misurazione prende il nome di indice glicemico (IG).
l'indice glicemico (IG) esprime la capacità dei carboidrati
contenuti negli alimenti di innalzare la glicemia
Si misura dapprima la glicemia a digiuno
Assunzione di 50 g di glucosio, da
parte del soggetto e si misura
La glicemia nel tempo
Successivamente viene assunta, dallo
stesso individuo una pari quantità di
carboidrati dell’alimento ed allo stesso
modo si misura la glicemia
Area so/o la curva del glucosio : 100 = Area so/o la curva dell'alimento : IG alimento da cui:
Indice glicemico = (area alimento / area glucosio) x 100
INDICE GLICEMICO DI ALCUNI ALIMENTI DI USO COMUNE
(prendendo come riferimento il glucosio)
Alimenti con indice glicemico basso (IG inferiore a 55)
Pasta, Lenticchie,
Mele/succo di mele, Pere
Arance/succo d’arancia
Uva, Yogurt magro
Fagioli lessi
Cioccolato
Alimenti con indice glicemico medio (IG compreso tra 55 e 70)
Banane
Fiocchi d’avena
Bibite analcoliche
Mais
Ananas
Zucchero
Alimenti con indice glicemico alto (IG superiore a 70)
Pane
Patate al forno
Cornflakes
Patatine fritte
Miele
Puré di patate
Riso bianco
Consumando alimenti ad alto indice glicemico:
• la glicemia sale di più e più in fretta;
• la risposta insulinica è più marcata;
• l'organismo si abitua ad utilizzare, preferenzialmente, gli zuccheri al posto dei
grassi;
• anche la trasformazione dello zucchero in grassi tende ad aumentare
(sovrappeso)
• Lo stress ossidativo aumenta (invecchiamento precoce, rischio oncologico)
• Dopo 2-4 ore la glicemia scende e torna la fame
• Nel tempo si crea un sovraccarico di lavoro per il pancreas che causa
Inizialmente insulinoresistenza e successivamente la comparsa del diabete
• Il rischio di carie dentaria è maggiore
Ossidazione Energia Apporto nutrizionale GLUCOSIO Deposito/ Interconversione Glicogeno Amminoacidi Acidi grassi Cervello Cuore Muscoli EritrociC Eccetera OMEOSTASI DELLA GLICEMIA La concentrazione del glucosio nel sangue (glicemia) viene mantenuta entro limiA abbastanza ristreB. Il meccanismo omeostaAco è mediato da diversi ormoni; tra quesA l’insulina tende ad abbassare la concentrazione del glucosio emaAco, mentre altri ormoni tendono ad aumentarla, come l’ormone della crescita GH e il glucacone (in condizioni normali), e i glicocorCcoidi e l’adrenalina (nel digiuno protra?o e nello stress). I meccanismi a?raverso cui quesA ormoni sono in grado di controllare la glicemia possono coinvolgere varie vie metaboliche (glicogenosintesi, glicogenolisi, neoglucogenesi, uAlizzazione alternaAva di altre fonA energeAche). L’effe?o degli ormoni sulla omeostasi glicemica non dipende solo dalla loro concentrazione assoluta, ma sopra?u?o dai rapporA di concentrazione (bilanciamento) con gli ormoni che esercitano un effe?o opposto (ormoni antagonisA). Dopo un periodo ada?o di digiuno (almeno 4 ore) la glicemia a?esa è 65-­‐110 mg/dl. Durante le prime due ore dopo il pasto, o dopo assunzione di glucosio, si realizza l’assorbimento intesAnale di glucosio con aumento della glicemia. L’immediata conseguenza è l’aumento di 10-­‐15 volte dei tassi insulinemici e la caduta di concentrazione del glucagone e del GH. L’interazione di quesA differenA parametri determina un incremento della glicemia fino ad un valore massimo che si verifica dopo circa un’ora dal pasto e che in genere non supera il valore di 160-­‐180 mg/
dl. In seguito la glicemia inizia a diminuire fino a valori di 120 mg/dl alla seconda ora; tra la seconda e la quarta ora dopo il pasto, la glicemia conAnua a diminuire progressivamente pur mantenendosi a valori lievemente superiori a quello basale. Quando il digiuno si protrae oltre le 4 ore, il tasso insulinemico diminuisce notevolmente e diventano allora preminenA gli effeB degli ormoni antagonisC che sAmolano la produzione di glucosio da parte del fegato aBvando la glicogenolisi e la glucogenesi. Nella situazione di digiuno protra?o, il 60% circa del glucosio prodo?o dal fegato serve al metabolismo cerebrale, mentre il rimanente viene uAlizzato dagli eritrociA e dai muscoli. L’altro effe?o degli ormoni antagonisA, glucocorAcoidi e GH, è rappresentato dallo sAmolo della lipolisi, con aumento in circolo degli FFA che vengono uAlizzaA a scopo energeAco sopra?u?o dal tessuto muscolare, con risparmio di glucosio; si ha però un aumento nella concentrazione di aceAl-­‐CoA che, trovandosi in eccesso, tende a dar luogo alla formazione dei corpi chetonici. Se poi la glicemia si abbassa a valori inferiori al normale (ipoglicemia), entra in funzione un meccanismo di emergenza addizionale, cosAtuito dalla secrezione di adrenalina, che aBva ulteriormente la glicogenolisi e sAmola la produzione di ACTH, con successivo aumento degli ormoni corAcosteroidi e aBvazione della gluconeogenesi. In ulAma analisi, una funzionalità corre?a e bilanciata delle isole del Langerans, dell’adenoipofisi, della corteccia e della midollare del surrene, consente di mantenere l’omeostasi glicemica in modo rapido e efficiente. Ormoni che controllano la glicemia Organo
Pancreas
Surrene
Ipofisi
Tiroide
Ormone
Azione
Effetto
su glicemia
Insulina
↑ Ingresso glucosio (tranne fegato, cervello,
RBC)
↑ glicolisi, glicogenosintesi epatica e sintesi
ac. grassi
↓ Lipolisi e gluconeogenesi
↓
Glucagone
↑ glicogenolisi e gluconeogenesi epatiche
↑ Lipolisi
↑
Somatostatina
↓ rilascio di insulina, glucagone e ormoni
ipofisari
(impedisce oversecrezione)
Adrenalina
↑ Glicogenolisi muscolare e lipolisi
↑
Cortisolo
↑ Gluconeogenesi da aa.
Antagonista dell’insulina
↑
ACTH
↑ Rilascio di cortisolo e lipolisi
↑
GH
Antagonista dell’insulina
↑
Tiroxina
↑ Glicogenolisi e gluconeogenesi epatica
↑ Assorbimento intestinale di zuccheri
↑
Effe, metabolici dell’insulina Processo
Trasporto glucosio
Glicolisi
Glicogenosintesi
Lipogenesi
Protidosintesi
Gluconeogenesi
Lipolisi
Azione
Tessuto(i)
+
+
+
+
+
-
Muscolare/Adiposo
Muscolare/Adiposo/
Epatico
Muscolare/Epatico
Adiposo/Epatico
Muscolare/Epatico
Epatico
Adiposo
Principali cause di iper-­‐ (>120 mg%) e ipo-­‐glicemia (<50 mg%) Iperglicemia
Ipoglicemia
Transitoria Stress emotivo/fisico acuto
Shock
Infarto miocardio
Convulsioni
Epatopatia grave
Feocromocitoma
Farmaci (salicilati, b bloccanti)
Alcolismo
Sepsi
Epatopatia grave
Glicogenosi
Persistente
Insulinoma
Glicogenosi tipo I
Diabete mellito
Sindrome di Cushing
(iperattività surrene)
Acromegalia (ipersecrez.
GH)
Ipertiroidismo
Obesità
mala$a
rischio rispe.o
ai non diabe2ci
Cecità*
20 volte
Insufficienza renale*
25 volte
Amputazione*
40 volte
Infarto miocardico
2 – 5 volte
Ictus
2 – 4 volte
Biochimica clinica del diabete mellito
e delle sue complicanze
• Diagnosi
– glicemia a digiuno/occasionale
– glicemia da carico
• Sorveglianza (del compenso metabolico)
– glicemia
– proteine (emoglobina) glicate
• Complicanze
– Microangiopatia: (micro)albuminuria
– Aterosclerosi: lipidi e lipoproteine
– Chetoacidosi: chetonuria, emogasanalisi
La diagnosi si pone se:
• Coesistono sintomi clinici (poliuria, polidipsia) ed un
valore glicemico “casuale” (ossia non
necessariamente a digiuno o dopo carico) >200 mg/
dL
oppure se:
• La glicemia a digiuno risulta >126 mg/dL (in due
diverse determinazioni)
oppure se:
• La glicemia a 2 ore da un carico orale di 75g di
glucosio risulta >200 mg/dL
Alterazioni della glicemia GLICEMIA BASALE (mg/dl) GLICEMIA 2 h. DOPO OGTT DIABETE DIABETE ALTERATA GLICEMIA A DIGIUNO ALTERATA TOLLERANZA AL GLUCOSIO NORMALE NORMALE IPOGLICEMIA OGTT -­‐ Test di Tolleranza al Glucosio per Os: disciolto in acqua per os • La prova, eseguita con diversi protocolli
(glucosio somministrato/tempo), ha avuto
grande rilevanza nel passato
• Oggi è meno utilizzata, anche perché
poco riproducibile
• Si raccomanda comunque un carico di 75g
e un prelievo dopo 2 ore
• Per il diabete gestazionale esistono due
protocolli, rispettivamente per screening
e conferma diagnostica
OGTT (Oral Glucose Tollerance Test) • Si effe?ua dopo 10 ore di digiuno, • dopo tre giorni di dieta libera (150-­‐200g carboidraA al di • Somministrare 75g di glucosio in 200 ml acqua • Prelievi: T0; T30; T60; T90; T 120. 1,75g/Kg peso nei bambini (sino a 50g) 100 g (1 tappa) o 50g + 100g (2 tappe) in gravidanza INDICAZIONI: oltre 45 anni, obesi, familiarità, aumentato rischio, ipertesi, dislipidemici, gravidanza (ripetere tra la 24° e la 28° seBmana e 6° seBmane dopo parto) Criteri interpretaAvi della OGTT Popolazione
Glicemia a 2 ore • Normale: < 140mg/dl • Rido?a tolleranza tra 140 e 199mg/dl • Diabete
> 200mg/dl Uno degli obieBvi principali della terapia del diabete è il raggiungimento e il mantenimento dell’euglicemia, intesa come valori glicemici più prossimi a quelli fisiologici, in relazione alle esigenze quoAdiane dell’organismo. L’euglicemia è di fondamentale importanza per o?enere un compenso metabolico oBmale e ridurre il rischio di insorgenza e progressione delle complicanze diabeAche. Il monitoraggio della glicemia da parte dei pazienA e degli operatori sanitari è considerato parte integrante della gesAone del diabete. I risultaA del monitoraggio vengono uAlizzaA per valutare l’efficacia della terapia e per apportare eventuali ada?amenA alla dieta, all’aBvità fisica e alla terapia farmacologia in modo tale da o?enere il miglior controllo glicemico possibile. • Il test del glucosio emaCco e urinario e il test dei chetoni nell’urina forniscono informazioni uAli sulla gesAone giornaliera del diabete. • UAle ,in parAcolar modo nelle fasi iniziali di stabilizzazione e di tra?amento, effe?uare un profilo glicemico. Esso va eseguito su 6 prelievi emaAci consecuAvi eseguiA 1) prima di colazione, 2) a metà maBnata, 3) prima di pranzo, 4) a metà pomeriggio, 5) prima di cena e 6) prima di coricarsi. Esso perme?e di valutare sia la concentrazione media di glucosio della giornata (MBG, dalle iniziali di Mean Blood Glucose concentra2on) sia le flu?uazioni giornaliere della glicemia (MAGE, dalle iniziali di Mean Amplitude of Glycemic Excursions). QuesA test però non offrono al paziente o al team medico una misura obieBva della glicemia per un lungo periodo di tempo. • Le misurazioni delle proteine glicate, in parAcolare l’emoglobina e le proteine sieriche, consentono una valutazione migliore della glicemia. Con una singola misurazione, quesA test quanAficano la glicemia media nell’ulAmo periodo (seBmane-­‐2 mesi), perfezionando il controllo giornaliero. Dosaggio del glucosio La glicemia va misurata subito dopo il prelievo oppure è necessario impedire alterazioni dei valori con l'aggiunta di stabilizzanA glicostaAci Apo fluoruro di sodio. Il metodo di analisi più uAlizzato per la glicemia prevede l'ossidazione del glucosio ed uAlizza l’enzima glucosio ossidasi . L'acqua ossigenata che si forma reagisce con un acce?ore di ele?roni in presenza di perossidasi e produce acqua ed un cromogeno bruno la cui assorbanza a 450 -­‐ 500 nm consente di risalire alla concentrazione emaAca di glucosio. Oscillazioni della concentrazione plasmatica di glucosio in un
soggetto diabetico. Glucosio è eliminato con le urine
(glicosuria) quando la concentrazione plasmatica sorpassa la
soglia di riassorbimento tubulare (soglia renale). Soglia renale La sorveglianza del diabetico mira
a verificare lo stato del controllo
glicometabolico, mentre la terapia
tende a ricondurlo alla norma. La
glicemia è l’indicatore del controllo
glico-metabolico, ma i sui valori
sono soggetti a variazioni
giornaliere marcate, rapide ed
imprevedibili.
• Il controllo sistemaCco della glicosuria delle 24 ore può in effeb indicare l’evento di una pregressa puntata iperglicemica anche in presenza di glicemia normale nella fascia oraria (8.00-­‐10.00) dei prelievi “di rouCne“ • Ciò tu/avia non presenta una “praCcabilità” consistente con una sorveglianza sistemaCca di tub i pazienC • Inoltre, picchi iperglicemici al diso/o della soglia renale (cira 180-­‐190 mg/dL) non danno comunque luogo a glicosuria Esiste quindi il problema di effe/uare una verifica “retrospebva” del controllo glicemico senza dover effe/uare prelievi ripetuC Misura delle proteine glicate per la sorveglianza del
compenso glico-metabolico nel diabetico
• Principio: in un ambiente contenente
glucosio, questo si lega stabilmente alle
proteine, che risultano “glicate”.
• L’entità della glicazione è proporzionale
all’integrale della concentrazione di glucosio
per il tempo di contatto
• La glicazione è un processo lento: l’entità è
limitata dalla vita media della proteina
L’emoglobina glicosilata rappresenta il prodo?o di una reazione non enzimaAca tra una molecola di glucosio e il gruppo amino-­‐terminale della valina della catena b dell’emoglobina. Ciò avviene in due fasi: la prima reversibile, che conduce alla formazione di una base di Schiff (aldimina), e una seconda irreversibile con la formazione di un prodo?o di Amadori, la chetoamina. La formazione di HbA1c avviene durante tu?o il periodo di vita del globulo rosso e dipende anche dall’età cellulare. Un incremento transitorio della glicemia può produrre la formazione di una notevole quanAtà di aldimine, reazione comunque reversibile con la normalizzazione dei valori glicemici. La persistenza di iperglicemia, tu?avia, rende tale reazione irreversibile, per cui la molecola di emoglobina resterà “glicata” sino alla morte del globulo rosso. La relazione tra valore glicemico medio e percentuale di Hb-­‐glic è stata dimostrata. Generalmente, ogni aumento di 1% dell’Hb-­‐glic corrisponde ad un aumento della glicemia pari a 35 mg/dl di glucosio plasmaAco medio. reversibile irreversibile veloce lenta HbA1c
labile
HbA1c
stabile
Reazione non enzimatica di condensazione tra il gruppo aldeidico del
glucosio e il gruppo amminico N-terminale delle catene β della Hb.
HbAo
Hb glicata
HbA1c
HbA3
HbF
HbA1a+b
α-chain
L’a?endibilità dell’HbA1c quale marker del controllo glicemico può essere rido?a anche dalle situazioni che modificano la vita media delle emazie. Ad esempio, valori elevaA di HbA1c in presenza di un MBG normale può essere osservato nei casi in cui il turnover delle emazie è rido?o, come avviene nei casi di diabete associaA ad anemia non tra?ata da carenza di ferro, acido folico, vitamina B12 o per emoglobinopaAe (Hb fetale, anemia a cellule falciformi). La condizione opposta, con un valore falsamente basso di HbA1c rispe?o all’MBG, si riscontra nei casi in cui vi siano in circolo percentuali maggiori di eritrociA giovani come avviene in corso di emolisi, e nei pazienA in tra?amento con Fe, vitamina B12 e folaA. Valori più elevaA di HbA1c sono rilevabili anche in corso di insufficienza renale cronica, a causa di un’interferenza nel dosaggio dell’HbA1c da parte dell’emoglobina carbamilata in presenza di elevate concentrazioni di urea. Questo problema, tu?avia, si verifica solo con alcune metodiche (cromatografia su colonna e a scambio ionico, ele?roforesi su agar-­‐gel) e può essere superato uAlizzando altre metodiche (cromatografia per affinità boronato–agarosio che rileva le stru?ure ketaminiche sui gruppi NH2 terminali della valina e lisina). Glicemia (mg/dL)
glicoHb (%)
65
4,0
101
5,0
137
6,0
172
7,0
208
8,0
244
9,0
279
10,0
315
11,0
350
12,0
Oltre alla Hb, altre proteine si “glicano”: la loro
misura può fornire indicazioni sul controllo glicemico
• In un dato momento, l’entità della glicazione
misurabile è una misura retrospettiva dell’integrale
“concentrazione di glucosio su tempo”, per un
intervallo di tempo dipendente dalla vita media
della proteina
• Per le proteine più utilizzate l’intervallo di tempo è
dell’ordine di:
– emoglobina del sangue 6-12 settimane;
– proteine (albumina) del siero 3-5 settimane
• La glicazione della emoglobina viene stimata
misurando la percentuale glicata ed
espressa come come percentuale della Hb
totale (%Hb)
• La glicazione delle sieroproteine (albumina)
viene misurata come “fruttosammina” ed
espressa in µmol/L
Metodo cineAco-­‐colorimetrico per la determinazione delle fru?osamine Principio Le fru?osamine del siero in ambiente alcalino sono presenA so?o forma idrossilaminica. Il gruppo idrossilaminico riduce il nitroblutetrazolio (NBT) rendendo evidente la produzione di formavano. La reazione che si sviluppa è dire?amente proporzionale alla concentrazione delle fru?osamine nel siero Misura delle proteine glicate:
emoglobina glicata o fruttosammina
• La misura della Hb glicata è maggiormente
standardizzata analiticamente e validata
clinicamente: è largamente usata in tutto il mondo
• Si può utilizzare in sostituzione la fruttosammina
quando:
– E’ necessaria una informazione relativa ad un periodo
precedente più breve (per es. valutazione degli effetti di
variazione terapeutica)
– Esistono ragioni biologiche (es. anemia emolitica) od
analitiche (es. presenza di varianti emoglobiniche) che
rendono inaffidabile la misura della Hb glicata
Il controllo glicemico può essere valutato anche con la determinazione di altre proteine sogge?e a glicosilazione (chetoamine) quali la fru?osamina (test della fru?osamina). È stata dimostrata una buona correlazione tra il test della fru?osamina e dell’HbA1c, ma è necessario tenere in considerazione che: 1) le variazioni biologiche soggeBve della fru?osamina sono maggiori rispe?o all’HbA1c; 2) il turnover dell’albumina rispe?o all’emoglobina è più breve (circa 28 gg. vs 120 gg. rispeBvamente) e per cui il test delle fru?osamina fornisce indicazioni sul controllo glicemico delle ulAme 2 seBmane; 3) il risultato deve essere corre?o in base alla concentrazione emaAca di albumina; 4) valori falsamente bassi possono essere riscontraA in condizioni di aumentato turnover proteico, quali le enteropaAe proteino-­‐disperdenA e la sindrome nefrosica; IL CICLO
NUTRIZIONE / DIGIUNO ASPETTI GENERALI FASE DI ASSORBIMENTO
• 2-4 ore successive all’assunzione di un pasto.
• E’ caratterizzata da un transitorio ↑ della concentrazione ematica di
glucosio, amminoacidi e trigliceridi.
Il pancreas risponde con:
• ↑ della secrezione di INSULINA
• ↓ della secrezione di GLUCAGONE
• L’elevato rapporto INSULINA/ GLUCAGONE e la disponibilità di substrati
porta ad un ↑ della sintesi di trigliceridi, glicogeno e proteine.
• Durante questa fase praticamente tutti i tessuti utilizzano il glucosio come
fonte di energia.
Variazione delle attività enzimatiche nella condizione di
apporto di nutrienti
• Il flusso di intermedi lungo le vie metaboliche è controllato da 4
meccanismi:
• 1) disponibilità di substrati
• 2) attivazione o inibizione allosterica di enzimi
• 3) modificazioni covalenti di enzimi (p.es. fosforilazione o
defosforilazione)
• 4) induzione o repressione della sintesi di enzimi
(p.es. l’ ↑ di insulina produce un ↑ della sintesi di enzimi chiave del
metabolismo anabolico).
• Nelle condizioni di apporto alimentare, tali meccanismi
garantiscono che i nutrienti disponibili siano trattenuti sotto
forma di glicogeno, trigliceridi e proteine.
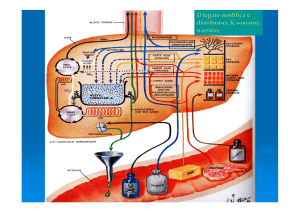
FEGATO • Occupa una posizione strategica per l’elaborazione e la distribuzione dei
nutrienti di provenienza alimentare.
• Ha infatti il ruolo di attenuare le fluttuazioni dei nutrienti a disposizione
dei tessuti periferici.
************
• Il sangue che il fegato riceve dopo un pasto (v. porta) è ricco di nutrienti
e contiene un elevato livello di insulina.
• Durante il periodo dell’assorbimento intestinale, il fegato assume
carboidrati, lipidi e gran parte degli amminoacidi *
• Questi nutrienti saranno poi:
(a) metabolizzati e conservati
oppure
b) instradati verso altri tessuti.
•
*gli AA a catena ramificata, leucina, isoleucina e valina, sfuggono al metabolismo epatico
FEGATO: metabolismo dei carboidrati
• Normalmente il fegato produce glucosio piuttosto che consumarlo.
• Dopo un pasto contenente carboidrati, il fegato trattiene
≈ 60% degli zuccheri presenti nel sangue portale e li utilizza per le
sue attività.
• Il metabolismo epatico del glucosio ↑ attraverso diversi meccanismi:
(1) ↑ fosforilazione del glucosio (glucochinasi)
(2) ↑ sintesi del glicogeno (attivazione della glicogenosintasi)
(3) ↑ attività della via dei pentosi
(4) ↑ glicolisi (la conversione del glucosio in acetil CoA è stimolata dal
rapporto elevato Insulina/Glucagone; L’Acetil CoA è utilizzato nella
sintesi degli Ac. Grassi o per generare energia nel Ciclo di Krebs)
(5) ↓ gluconeogenesi (scarsa attività della piruvato carbossilasi e
inibizione di altri enzimi della via)
Fegato: metabolismo dei grassi ↑ sintesi degli Ac. Grassi
• Il fegato è il tessuto principale nel quale avviene la sintesi ex novo degli
acidi grassi.
• La sintesi degli Ac. Grassi è favorita dalla disponibilità di substrati
(acetil CoA e NADPH) derivanti dal metabolismo del glucosio.
↑ sintesi dei Trigliceridi
• E’ favorita dalla disponibilità di acetil CoA (proveniente sia dalla sua
sintesi ex novo sia dall’idrolisi dei trigliceridi presenti nei remnants dei
chilomicroni).
• Il fegato introduce i trigliceridi nelle VLDL, secrete nel sangue ed
utilizzate di tessuti extraepatici (soprattutto t. adiposo e t.
muscolare)
Fegato: metabolismo degli Amminoacidi (AA)
↑ della degradazione degli AA(*)
• la disponibilità di AA è > necessità delle cellule
• gli AA eccedenti sono:
(1) liberati nel sangue e usati da altri tessuti (sintesi proteica)
(2) deaminati → scheletri carboniosi → piruvato, acetil CoA o altri
intermedi del ciclo di Krebs →ossidazione o sintesi Ac. Grassi
(*) N.B. Gli AA a catena ramificata (leucina, isoleucina e valina) sfuggono al
metabolismo epatico e sono assunti dal tessuto muscolare.
↑ della sintesi proteica
• sostituzione di proteine degradate nel periodo precedente
TESSUTO ADIPOSO • Dopo il fegato, il tessuto adiposo è secondo per capacità di
distribuire molecole di combustibile.
• In un uomo di 70 kg, rappresenta il 20% circa.
• Negli individui obesi, può costituire fino al 70% della massa
corporea.
Metabolismo dei carboidrati
• ↑ del trasporto del glucosio (sensibile alla [insulina] nel sangue)
• ↑ della glicolisi (fornisce il glicerolo fosfato per la sintesi dei
trigliceridi)
• ↑ della via dei pentosi (producendo NADH necessario per la
sintesi dei grassi)
TESSUTO ADIPOSO
Metabolismo dei grassi
↓ della degradazione dei trigliceridi (inibizione della lipasi ormone- sensibile)
↑ della sintesi dei trigliceridi
• L’innalzamento della glicemia e dell’insulinemia favoriscono l’accumulo di
trigliceridi.
• Gli Ac. Grassi esogeni (chilomicroni e VLDL) si liberano per azione della
lipoproteina lipasi (legata alle pareti dei capillari sanguigni, spt del t. adiposo e
muscolare).
• Il glicerolo 3-P per la sintesi dei trigliceridi proviene dal metabolismo del
glucosio poiché gli adipociti non contengono la glicerolo chinasi.
↑ della sintesi degli Ac. Grassi
• N.B. La sintesi ex novo a partire dall’Acetil CoA è molto limitata, tranne nei casi
di alimentazione dopo un periodo di digiuno. La maggior parte degli Ac. Grassi
deriva dai grassi della dieta (chilomicroni) ed una piccola quantità dalle VLDL.
MUSCOLO SCHELETRICO • Il consumo di O2 a riposo è circa il 30% del consumo corporeo totale ma
può arrivare al 90% durante un esercizio fisico intenso.
• Il muscolo scheletrico è pertanto un tessuto ossidativo (benchè abbia la
potenziale capacità di utilizzare per un periodo transitorio la glicolisi
anaerobica).
N.B.
Il muscolo cardiaco differisce da quello scheletrico per 3 aspetti:
(1) è in continua attività mentre i muscoli si contraggono in maniera intermittente
(2) ha un metabolismo completamente aerobico
(3) contiene riserve energetiche (glicogeno e lipidi) in quantità trascurabile.
Le sostanze da cui ricava energia sono il glucosio libero, gli Ac. Grassi ed i corpi
chetonici.
Ne consegue che una condizione di ischemia provoca rapidamente la morte dei
cardiomiociti.
MUSCOLO SCHELETRICO
Metabolismo dei carboidrati
• ↑ del trasporto del glucosio (sensibile alla [insulina] nel sangue), che verrà
fosforilato e poi metabolizzato.
• ↑ sintesi del glicogeno, soprattutto se le scorte sono state esaurite in
precedenza in seguito ad esercizio fisico.
N.B. Il glucosio è il principale combustibile nella fase di apporto di nutrienti!
Metabolismo degli Ac. Grassi
Gli Ac. Grassi si liberano dai chilomicroni e dalle VLDL per azione della lipoproteina
lipasi.
N.B. Nel periodo di apporto di nutrienti gli Ac. Grassi sono combustibili di secondaria
importanza!
Metabolismo degli Amminoacidi
• ↑ sintesi proteica (sostituzione di proteine catabolizzate nella fase precedente)
• ↑ uptake di AA a catena ramificata (sfuggono al metabolismo epatico), usati
come fonte energetica e per la sintesi proteica.
L’ENCEFALO
• L’encefalo consuma il 20% (a riposo) dell’ossigeno utilizzato
dall’organismo, benchè contribuisca solo per il 2% alla massa corporea
di un adulto.
• L’encefalo consuma energia a ritmo costante
• I substrati, per poter essere utilizzati, devono superare la “barriera
emato-encefalica”
• Il glucosio normalmente funge da combustibile primario
• I corpi chetonici, in quanto combustibili, svolgono un ruolo
significativo nei periodi di digiuno.
•
N.B. Se la glicemia crolla ad un livello < 30 mg/100ml (V.N. 70-90 mg/100 ml) la
funzionalità cerebrale è compromessa.
ENCEFALO Metabolismo dei Carboidrati
• L’encefalo dipende completamente dalla disponibilità del glucosio
ematico in quanto non contiene scorte significative di glicogeno.
• Nelle condizioni di apporto di nutrienti, l’encefalo utilizza
esclusivamente il GLUCOSIO come combustibile (ne ossida
completamente circa 140 g/die a CO2 ed H2O).
Metabolismo dei Grassi
• L’encefalo non contiene scorte significative di trigliceridi
• Gli Ac. Grassi presenti nel sangue non attraversano con efficienza la
barriera emato-encefalica.
DIGIUNO
CAUSE
1) impossibilità di reperire del cibo
2) desiderio di perdere peso rapidamente
3)impossibilità ad alimentarsi in seguito ad un trauma, ad un intervento chirurgico, ad una
neoplasia ecc.
EFFETTI
• I livelli plasmatici del Glucosio, degli Amminoacidi e dei Trigliceridi tendono a ↓
• La secrezione di INSULINA ↓ mentre quella del GLUCAGONE ↑
• Il periodo di digiuno è un periodo CATABOLICO, caratterizzato dalla degradazione di
Trigliceridi, Glicogeno e Proteine.
• S’ innesca uno scambio di substrati tra FEGATO, Tessuto Adiposo, Tessuto
Muscolare ed Encefalo, sotto la spinta di due priorità:
• 1) mantenere costante la glicemia
• 2) mobilizzare Ac. Grassi dal Tessuto Adiposo ed attivare la sintesi dei Corpi
Chetonici.
Le scorte energetiche (in un adulto di 70 Kg di peso corporeo)
• Costituite soprattutto da trigliceridi (20% circa del peso)
• Proteine (8,5% circa del peso).
N.B. Solo 1/3 circa delle proteine corporee può essere utilizzato per la produzione di energia senza
compromettere le funzioni vitali poiché ciascuna proteina ha una propria funzione (p.es. enzima,
componente strutturale etc.)
• Glicogeno (0,3% circa del peso)
I cambiamenti enzimatici nel digiuno
Nel digiuno, il flusso di intermedi lungo le vie del metabolismo intermedio è controllato dagli
stessi meccanismi che intervengono nelle condizioni di apporto di nutrienti:
• 1) disponibilità di substrati
• 2) attivazione o inibizione allosterica di enzimi
• 3) modificazioni covalenti di enzimi (p.es. fosforilazione).
La maggior parte è nello stato fosforilato ed è inattiva.
• 4) induzione o repressione della sintesi di enzimi
N.B. Molte modificazioni sono opposte rispetto all’apporto di nutrienti.
IL FEGATO (durante il digiuno)
• Il fegato ha un ruolo primario nel metabolismo energetico,
che consiste nella sintesi e nella distribuzione di molecole di combustibile
ad altri organi.
Metabolismo dei Carboidrati
(1) ↑ della glicogenolisi
• L’aumentato rapporto tra glucagone ed insulina provoca una rapida
mobilizzazione delle scorte epatiche di glicogeno.
• E’ una risposta transitoria che avviene nella prima fase del digiuno.
• Il glicogeno epatico (100 g circa) è quasi esaurito dopo 10-18 ore di digiuno.
(2) ↑ della gluconeogenesi
• La gluconeogenesi inizia da 4 a 6 ore dopo l’ultimo pasto e raggiunge la
massima attività quando le scorte di glicogeno sono esaurite.
• Ha un ruolo essenziale nel mantenimento della glicemia sia ne digiuno
notturno sia in quello prolungato.
IL FEGATO (durante il digiuno)
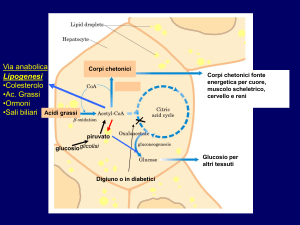
Metabolismo dei grassi
• ↑ dell’ossidazione degli Ac. Grassi provenienti dal tessuto adiposo (è la
principale fonte di energia per il fegato durante la fase di postassorbimento)
• ↑ della sintesi dei corpi chetonici
E’ una prerogativa del fegato!
Gli acidi Acetoacetico e β-idrossibutirrico sono trasportati dal sangue ai
tessuti, dove potranno essere riconvertiti in acetil CoA che sarà
ossidato nel ciclo di Krebs. L’acetone non è metabolizzabile.
N.B.
1) Il fegato, essendo privo dell’enzima tioforasi, non può utilizzare come combustibile i
corpi chetonici!
2) La disponibilità di corpi chetonici in circolo è importante perché riducendo il bisogno
di sintetizzare glucosio attraverso la gluconeogenesi a partire daglischeletri
carboniosi di AA, rallenta la perdita di proteine essenziali.
TESSUTO ADIPOSO (digiuno) Metabolismo dei Carboidrati
• Il trasporto del glucosio negli adipociti ed il suo successivo metabolismo sono
depressi (per il basso livello d’insulina) → ridotta sintesi di Ac. Grassi e di
Trigliceridi.
Metabolismo dei Grassi
• ↑ idrolisi dei Trigliceridi di deposito (per ↑ dell’Adrenalina e soprattutto della
Noradrenalina, che stimolano l’attività della lipasi sensibile agli ormoni).
• ↑ liberazione degli Ac. Grassi in circolo.
Legati all’albumina, essi raggiungono un molteplicità di tessuti e sono utilizzati
per produrre energia.
Il glicerolo prodotto dalla degradazione dei trigliceridi è utilizzato dal fegato
come precursore gluconeogenico.
• ↓ assunzione degli Ac. Grassi. L’attività della lipoproteina lipasi è bassa pertanto
i trigliceridi, presenti in circolo nelle lipoproteine, non si rendono disponibili.
MUSCOLO SCHELETRICO (digiuno) • Il muscolo a riposo utilizza gli Ac. Grassi come fonte
principale di energia.
• Il muscolo in esercizio inizialmente utilizza le scorte di
glicogeno (durante uno sforzo intenso, il glucosio 6-P è
convertito in lattato con la glicolisi anaerobica);
successivamente la fonte principale diventano gli acidi grassi
liberi (derivanti dalla mobilizzazione dei trigliceridi del t.
adiposo).
Metabolismo dei Carboidrati
Il trasporto del glucosio all’interno delle fibre è depresso
(basso livello d’insulina)
MUSCOLO SCHELETRICO (digiuno)
Metabolismo dei lipidi
Durante le prime due-tre settimane di digiuno, il muscolo utilizza
sia Ac. Grassi che Corpi Chetonici. Successivamente utilizza
quasi esclusivamente Ac. Grassi.
N.B. La ↓ utilizzazione dei Corpi Chetonici da parte del muscolo provoca un ↑della loro
[plasmatica], cui fa seguito una loro > utilizzazione da parte dell’encefalo.
Metabolismo delle proteine
• Durante i primi giorni, si ha una rapida demolizione delle proteine
muscolari, per fornire al fegato AA da utilizzare per la
gluconeogenesi (spt. Alanina e glutammina).
• Dopo varie settimane di digiuno, la velocità della proteolisi
diminuisce, poiché l’encefalo ha iniziato ad utilizzare i corpi
chetonici come fonte di energia.
L’ENCEFALO (digiuno) • Durante i primi giorni, l’encefalo utilizza a scopo energetico
esclusivamente glucosio (ottenuto grazie alla
gluconeogenesi).
• Nel digiuno protratto (oltre 2-3 settimane), i corpi chetonici
raggiungono livelli significativamente elevati e l’encefalo li
utilizza come combustibili, in aggiunta al glucosio.
In tal modo si riduce la richiesta di un catabolismo proteico
per alimentare la gluconeogenesi.
Da Champe et al. - Le basi della Biochimica- Zanichelli
AMP is a sensiAve indicator of Cellular Energy Capacity AMP-­‐acCvated protein kinase (AMPK) global mobilizaCon of energy stores