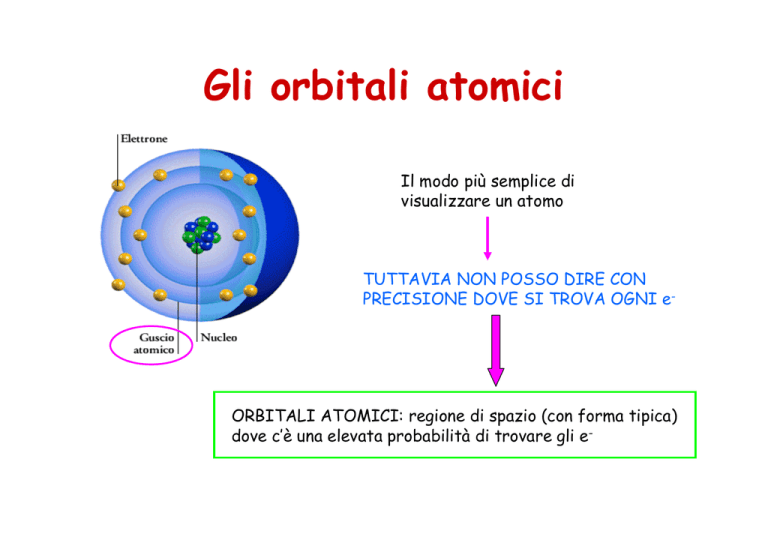
Gli orbitali atomici
Il modo più semplice di
visualizzare un atomo
TUTTAVIA NON POSSO DIRE CON
PRECISIONE DOVE SI TROVA OGNI e-
ORBITALI ATOMICI: regione di spazio (con forma tipica)
dove c’è una elevata probabilità di trovare gli e-
Caratteristiche degli orbitali
…i numeri quantici
Numero quantico principale (n)=1, 2, …
(definisce il livello energetico o il guscio)
Numero quantico secondario (l)= da 0 a (n-1)
(definisce la forma)
Numero quantico magnetico (m)= da –l a +l
(definisce l’orientazione nello spazio)
Numero quantico secondario
l=0
orbitale s
l=1
orbitale p
l= 2
orbitale d
l=3
orbitale f
(sfera)
(lobo)
Primo guscio:
n =1
l= o
m= 0
Al primo guscio (n=1) esiste un solo orbitale s
1s
1s
Secondo guscio:
n=2
l= 0 (s)
l=1 (p)
m= 0
m=0
m=-1
m=+1
Nel secondo guscio ci sono un orbitale s e tre orbitali p
2s
2p
Terzo guscio:
n=3
l= 0 (s)
m= 0
l=1 (p)
m=-1
m=0
m=+1
l= 2 (d)
m=-2
m=-1
m=0
m=+1
m=+2
Un orbitale s, 3 orbitali p, 5 orbitali d
3s
3p
3d
Quarto guscio:
n=4
l= 0 (s)
m= 0
l=1 (p)
m=-1
m=0
m=+1
l= 2 (d)
m=-2
m=-1
m=0
m=+1
m=+2
Un orbitale s, 3 orbitali p, 5 orbitali d, 7 orbitali f
4s
4p
4f
4d
l= 3 (f)
m=-3
m=-2
m=-1
m= 0
m=+1
m= +2
m=+3
Visualizzazione d’insieme
Gli orbitali atomici di uno stesso
atomo penetrano l’uno nell’altro,
cioè hanno delle regioni comuni
1s 2s 2p 3s 3p 4s 3d…………
I tre numeri quantici (n, l, m) definiscono ciascun orbitale, sede di
elettroni
Per descrivere completamente un elettrone è necessario conoscere
un ulteriore numero quantico (magnetico di spin)
Quanti elettroni ci sono in ogni
orbitale?
Numero di spin
+ 1
2
-1
2
Principio di esclusione
In un atomo non
possono coesistere
due o più elettroni
con i 4 numeri
quantici uguali
Intorno al 1920: l’elettrone è dotato di movimento rotatorio su se stesso
Configurazione elettronica
1)
2)
3)
Come si distribuiscono gli elettroni negli orbitali
disponibili?
TRE REGOLE IMPORTANTI
Gli elettroni occupano gli orbitali a partire da quelli
con energia più bassa (guscio più interno)
Principio di esclusione di Pauli: in un orbitale non
possono stare più di due elettroni
Regola di Hund: gli elettroni occupano il maggior
numero di orbitali con la stessa energia
Esempio : idrogeno H, Z= 1
1s 2s 2p 3s 3p 4s 3d..
Esempio: Elio He, Z= 2
1s 2s 2p 3s 3p 4s 3d..
1s 2s 2p 3s 3p 4s 3d..
Calcio (Ca) Z= 20
1s2 2s2 2p6 3s2 3p6 4s2
Arsenico (As) Z=33
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
Configurazione elettronica esterna
1s2 2s2 2p6 3s2 3p6 4s2
Indicata anche come (Ar) 4s2
Elettroni esterni o di valenza: intervengono nella formazione dei legami
Si trovano negli orbitali a più alta energia
Il sistema periodico di
Mendeleev
Mendeleev (1834-1907) ordinò (assegnando dei “numeri d’ordine)
gli elementi secondo la massa atomica crescente, andando a capo
(cioè iniziando una nuova riga) ogni volta che certe
caratteristiche tornavano a presentrasi, in modo da disporre in
una stessa colonna ,l’uno sotto l’altro, gli elementi con
comportamenti simili.
“periodico”: a intervalli regolari si ritrovano elementi con
caratteristiche simili
Nel 1913 venne introdotto il numero atomico
Il numero atomico di un elemento coincide con il numero”d’ordine”stabilito
da Mendeleev
Nel sistema periodico gli elementi sono ordinati secondo
il numero atomico crescente
IA
VIII A
IIA
IIIA
Gruppi B
IVA
VII A
VA
VI A
La tavola periodica: gruppi e periodi
gruppi: colonne verticali della tavola periodica
• congeneri: membri del gruppo(stessa configurazione
elettronica esterna!)
NB: IA (1 elettrone), IIA (2 elettroni)…… VIIIA( 8
elettroni)
• metalli alcalini (primo gruppo IA)
• metalli alcalino-terrosi (secondo gruppo IIA)
• gas nobili (VIIIA)
• alogeni (VIIA)
• metalli di transizione
periodi: righe orizzontali della tavola periodica (gli
atomi di un periodo hanno lo stesso numero di gusci)
Suddivisione in blocchi
Scendendo lungo un gruppo aumenta il numero quantico principale n (aumenta
il numero di gusci)
Avanzando lungo un periodo aumenta il numero di elettroni sul guscio di
valenza (guscio esterno)
Blocco s
Gli atomi di questo blocco hanno
configurazione elettronica esterna
nsx
n=numero di gusci
X= numero di elettroni contenuti
nell’orbitale s
Blocco p
Gli atomi di questo
blocco hanno
configurazione
elettronica esterna
ns2npx
n=numero di gusci
X= numero di
elettroni contenuti
negli orbitali p
Blocco d (metalli di transizione)
La loro comparsa nella tavola periodica coincide con il
riempimento progressivo degli orbitali d
Hanno configurazione elettronica del tipo (n-1)dznsx
n= periodo;z=da 1 a 10; x=2(in genere)
Cromo (Z=24)
1s2 2s2 2p6 3s2 3p6 4s2 3d5
(n-1)dznsx
n=periodo=4
3d5 4s2
Blocco f
(n-2) fx(n-1)dyns2
Suddivisione della tavola periodica che useremo di più: in base al
comportamento chimico
(v.oltre)
Grandezze che variano
periodicamente
1) dimensione degli atomi
2) energia di ionizzazione
3) affinità elettronica
Dimensione(raggio) degli atomi
Lungo un gruppo dall’ alto in basso la
dimensione degli atomi AUMENTA
Il numero dei gusci aumenta scendendo
lungo un gruppo
3 gusci
2 gusci
1 guscio
Dimensione(raggio) degli atomi
Lungo un periodo, da sin a dx, DIMINUISCE
é
é
é
3+
6+
é
é
Secondo guscio
Secondo guscio
litio
carbonio
In generale si può concludere che:
La carica nucleare aumenta, lungo un periodo, e quindi gli elettroni del
livello esterno vengono attratti più fortemente dal nucleo: di conseguenza,
si verifica una contrazione delle dimensioni dell’atomo
Tuttavia dal gruppo VIA al gruppo VIIIA…
Si può assistere ad un LEGGERO aumento delle dimensioni atomiche in
seguito alla repulsione degli elettroni presenti del guscio più esterno…..
Esempio cfr: Ossigeno, Fluoro e Neon
O= 6 elettroni esterni;
F= 7 elettroni esterni; Ne= 8 elettroni esterni
L’ “affollamento”degli elettroni nel guscio più esterno prevale
sull’aumento della carica nucleare; di conseguenza, per gli ultimi due
elementi la tendenza si inverte!!!!! Si noti che il Ne è comunque più
piccolo del Litio (primo elemento del secondo periodo)
O
F
Ne
Energia di ionizzazione
Energia richiesta per rimuovere un elettrone dallo
stato fondamentale di un atomo (si forma un
catione)
Energia di ionizzazione, in
generale……
• Aumenta lungo un periodo (da sn a dx)
(v. litio e carbonio)
Gli elettroni del C sono tenuti più
saldamente dal nucleo, avendo carica
nucleare maggiore
• Diminuisce lungo un gruppo (dall’alto in
basso)
Energia di PRIMA ionizzazione: necessaria togliere un
elettrone
Energia di seconda e terza ionizzazione: necessaria per
rimuovere altri elettroni (il secondo ed il terzo
rispettivamente)
Affinità elettronica
Affinità elettronica
E’ la variazione di Energia che si verifica
quando un atomo neutro isolato allo
stato gassoso quando acquista un
elettrone trasformandosi in uno ione
negativo (anione)
Lungo un periodo: AUMENTA
Lungo un gruppo: DIMINUISCE a causa
della maggiore distanza dell’ elettrone
aggiunto dal nucleo