Appunti di Stechiometria per Chimica
L'ATOMO
Il protone, il neutrone e l'elettrone
sono le tre particelle subatomiche che costituiscono l'atomo.
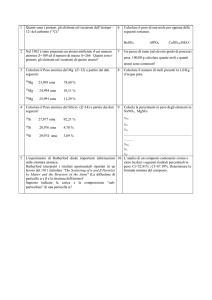
carica
massa
(C)
(e) (g)
(uma)
+1.6x10-19
+1 1.67x10-24
1.0073
neutrone 0
0 1.67x10-24
1.0087
elettrone -1.6x10-19
-1 9.1x10-28
5.5x10-4
protone
L'atomo è per convenzione l'unità costituente la materia (cioè tutto
ciò che ha massa)
L’atomo è costituito da un nucleo positivo centrale, formato da
protoni ed eventualmente neutroni, e da elettroni negativi
disposti esternamente al nucleo.
Il raggio di un atomo è dell'ordine di 1 Å (10-10 m).
Il nucleo ha un raggio di circa 10-5 Å (100000 volte più piccolo del
raggio atomico).
Il numero di protoni presenti nel nucleo di un atomo viene
definito come numero atomico Z.
La somma dei neutroni e dei protoni presenti nel nucleo di un
atomo viene definito numero di massa A.
In un atomo neutro il numero degli elettroni è uguale al numero
dei protoni (numero atomico Z).
Gli atomi che hanno uno specifico numero atomico vengono
chiamati specie atomica o elemento.
TAVOLA PERIODICA DEGLI ELEMENTI
Un atomo, caratterizzato da un certo numero atomico Z (numero
di protoni) e da un certo numero di massa A (numero di neutroni e
di protoni), viene chiamato nuclide e si indica con
è il simbolo dell'elemento.
, dove X
Nuclidi con lo stesso Z ma differente A si chiamano isotopi
Una stessa specie atomica ha, di norma, diversi isotopi. Si parla di
miscela isotopica naturale la composizione dei vari nuclidi di un
dato elemento presente in natura.
Alcuni nuclidi sono stabili, altri sono instabili (radioattivi) e
decadono mediante una reazione nucleare. La composizione del
nucleo in termini di protoni e neutroni determina la stabilità del
nuclide.
Nuclidi stabili
Isotopi naturali di alcuni elementi
Massa atomica
(uma)
% di nuclidi
1
1,007825
99,985
2
2,0140
0,015
3
3,01603
0.00013
4
4,00260
~ 100
6
6,01512
7,42
7
7,01600
92,58
9
Nuclide
H
H
He
He
Li
Li
9,01218
~ 100
10
Be
10,0135
tracce
10
10,0129
19,78
11
11,00931
80,22
12
12 (esatta)
98,89
13
13,00335
1,11
Be
B
B
C
C
Se una sostanza è costituita da una sola specie atomica si parla di
sostanza elementare.
Se una sostanza è formata da atomi di specie diverse si parla di
sostanza composta o più semplicemente composto.
L'unità di riferimento per la misura della massa degli atomi è
l'unità di massa atomica (uma o Dalton) definita come 1/12 della
massa del nuclide neutro 12C
Il Peso Atomico (o più correttamente Massa Atomica relativa) di
un elemento è la massa atomica media (pesata rispetto
all'abbondanza relativa degli isotopi naturali) dei vari nuclidi
neutri di un dato elemento relativa all'uma (dalton).
Il numero d'atomi presenti in 12 g di 12C (6.022x1023) è chiamato
Numero (o costante) di Avogadro.
La Mole è un'unità di quantità di sostanza che contiene un
Numero di Avogadro d'entità elementari quali atomi, molecole,
elettroni etc.
Il valore numerico della massa atomica espressa in uma è
equivalente al valore numerico della massa molare (massa di una
mole d'atomi) espressa in grammi
La massa atomica dell'idrogeno è
1,007825 × 0,99985 + 2,0140 × 0,00015 = 1,00797 uma
La massa di una mole d'atomi d'idrogeno è uguale a 1,00797 g
La massa atomica del carbonio è
12× 0,9889 + 13,00335 × 0,0111 = 12,0111 uma
La massa di una mole d'atomi di carbonio è uguale a 12,0111 g