CHIMICAMENTE
Lezioni del prof. Puletti
Classe II B
Scuola Media PIO X Artigianelli
A.S. 2011-2012
PERCORSO
- cos’è la materia e da cosa è costituita
- le particelle atomiche fondamentali: protoni, neutroni ed elettroni
- evoluzione dei modelli atomici
- gli orbitali e la regola dell’Aufbau
- la tavola periodica degli elementi
- gli atomi si aggregano: le molecole
- le reazioni e le equazioni chimiche
Attività di laboratorio
Informazioni tecniche prima di cominciare
Questa presentazione non sostituisce il lavoro da fare sul libro ma serve per
sottolineare quali sono le parti più importanti da trattenere.
1. Scaricate questa presentazione dal sito della scuola.
2. Come attività di laboratorio costruiremo dei modelli di atomi in classe.
Per questo è necessario acquistare del materiale che poi vi dirò.
3. Stampatevi a colori la Tavola Periodica di cui trovate il link in questa
presentazione.
Laboratorio di chimica a scuola
Costruiamo gli atomi
Materiale necessario
- Plastilina colorata (vari colori, soprattutto rosso, verde, giallo, blu)
- Stuzzicadenti da spiedini (più lunghi)
Cosa costruire
Atomi:
1.Idrogeno, 2.Carbonio, 3.Ossigeno, 4.Elio, 5.Neon, 6.Kripton,
7.Potassio, 8.Sodio, 9.Piombo
Molecole:
Acqua, anidride carbonica, ammoniaca, glucosio
Alcune domande (di ripasso) per iniziare
1a. Cos’è la massa?
1b. Qual è la sua unità di misura?
2a. Cos’è il volume?
2b. Qual è la sua unità di misura?
3a. Cos’è la densità?
3b. Qual è la sua unità di misura?
È la quantità di materia
posseduta da un corpo
Si misura con il Kgm
È lo spazio occupato da
un corpo
Si misura con il m3
È il rapporto tra massa e
volume di un corpo
Si misura con il Kgm/m3
Alcune domande (di ripasso) per iniziare
1a. Cos’è la massa?
1b. Qual è la sua unità di misura?
2a. Cos’è il volume?
2b. Qual è la sua unità di misura?
È la quantità di materia
posseduta da un corpo
Si misura con il Kgm
È lo spazio occupato da
un corpo
Si misura con il m3
Dunque: cos’è la materia?
[DEFINIZIONE]
Con la parola materia si indica
qualsiasi cosa abbia una massa e occupi uno spazio
oppure anche
la sostanza di cui gli oggetti fisici sono composti
Di cosa è fatta la materia?
ovvero: l’infinitamente piccolo
Quello che - ad oggi - è considerato l’unità fondamentale
della materia si chiama ATOMO
MA COME E’ FATTO UN ATOMO?
Di cosa è fatta la materia?
ovvero: l’infinitamente piccolo
I modelli atomici di Thomson, Rutherford e Bohr
Il “panettone” di Thomson (1898)
Thomson propose il primo modello fisico dell'atomo.
Immaginò che un atomo fosse costituito da una sferetta di materia caricata
positivamente (protoni e neutroni non erano stati ancora scoperti) in cui gli elettroni
negativi (da poco scoperti) erano immersi.
Di cosa è fatta la materia?
ovvero: l’infinitamente piccolo
I modelli atomici di Thomson, Rutherford e Bohr
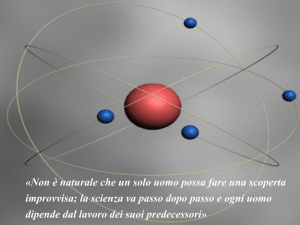
Rutherford (1911)
Fece un esperimento cruciale per mettere alla prova il modello di Thomson.
Propose un modello di atomo in cui quasi tutta la massa dell'atomo è concentrata in
una porzione molto piccola, il cosiddetto nucleo (caricato positivamente) e gli elettroni
gli ruotano attorno così come i pianeti ruotano attorno al sole.
Il modello di Rutherford ha però un grande "difetto" che lo mette in
crisi. Secondo la teoria elettromagnetica una carica in movimento
accelerato (non in moto rettilineo uniforme) emette onde
elettromagnetiche e quindi perde energia. Per questo motivo, gli
elettroni dell'atomo di Rutherford, perché ruotano su orbite circolari,
dovrebbero emettere onde elettromagnetiche e quindi, perdendo
energia, cadere nel nucleo cosa che invece non accade, perché gli
atomi sono oggetti molto stabili (la materia appare normalmente
stabile).
Di cosa è fatta la materia?
ovvero: l’infinitamente piccolo
I modelli atomici di Thomson, Rutherford e Bohr
Le correzioni di Bohr a Rutherford (1913)
Nel 1913 Bohr propose una modifica concettuale al modello di Rutherford. Pur
accettandone l'idea di "modello planetario", postulò che gli elettroni avessero a
disposizione orbite di "parcheggio“ fisse nelle quali non emettono né assorbono energia.
Un elettrone emette od assorbe energia elettromagnetica sotto forma di onde
elettromagnetiche solo se "salta" da un'orbita all'altra.
Questa idea, non compatibile con le leggi della fisica
classica (di Newton), si basa sulle idee della nascente
meccanica quantistica.
Di cosa è fatta la materia?
ovvero: l’infinitamente piccolo
I modelli atomici di Thomson, Rutherford e Bohr
Le correzioni di Bohr a Rutherford (1913)
Nel 1913 Bohr propose una modifica concettuale al modello di Rutherford. Pur
accettandone l'idea di "modello planetario", postulò che gli elettroni avessero a
disposizione orbite di "parcheggio“ fisse nelle quali non emettono né assorbono energia.
Un elettrone emette od assorbe energia elettromagnetica sotto forma di onde
elettromagnetiche solo se "salta" da un'orbita all'altra.
Questa idea, non compatibile con le leggi della fisica
classica (di Newton), si basa sulle idee della nascente
meccanica quantistica.
Quali sono le componenti principali di un atomo?
+
-
+
-
-
SALI DI LITIO
Caratteri chimici del Litio
NEUTRONE
Numero di protoni: 3
Numero di neutroni: 4
Massa atomica (protoni + neutroni): 7
Numero atomico (num. di protoni o elettroni): 3
+
PROTONE
-
ELETTRONE
La tavola periodica: dov’è il Litio?
Scarica dal link qui riportato e stampa (a colori!) la tavola periorica
http://www.ptable.com/?lang=it
PERIODI
GRUPPI
Nato a Tobol'sk (Siberia), 8 febbraio 1834
Morto a San Pietroburgo nel 1907.
Principio di costruzione della configurazione elettronica di un atomo
detto
Regola Aufbau (=costruzione)
Cosa è l’ORBITALE?
Alla base del principio dell’aufbau c’è il
Principio di minima energia:
ogni elettrone occupa l'orbitale disponibile a
energia più bassa.
Utilizziamo la regola dell’AUFBAU
Seguendo la regola dell’aufbau
disponi gli elettroni di questi atomi:
…
III
II
I
- Idrogeno
- Elio
- Ossigeno
- Fosforo
- Litio
- Carbonio
- Neon
- Argon
Laboratorio di chimica a scuola
Costruiamo gli atomi
Materiale necessario
- Plastilina colorata (vari colori, soprattutto rosso, verde, giallo, blu)
- Stuzzicadenti da spiedini (più lunghi)
Cosa costruire
Atomi:
1.Idrogeno, 2.Carbonio, 3.Ossigeno, 4.Elio, 5.Neon, 6.Kripton,
7.Potassio, 8.Sodio, 9.Piombo
Molecole:
Acqua, anidride carbonica, ammoniaca, glucosio
La fotosintesi come esempio di reazione chimica
Reazioni ed equazioni chimiche
Che differenza c’è tra equazione chimica e reazione chimica?
La reazione chimica è un fenomeno chimico
(che consiste in una trasformazione della materia)
L’equazione chimica è la rappresentazione di tale fenomeno
FENOMENO
EQUAZIONE
6 CO2
+
Luce
6 H2O → C6H12O6 +
6 O2
(6 Anidride carbonica) + (6 Acqua) → (Glucosio) + (6 Ossigeno)