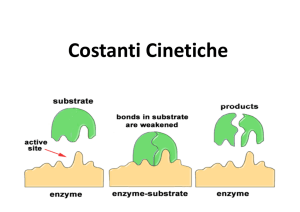
Gli enzimi:
Aumentano la velocita’ di reazione in condizioni
“fisiologiche”, sono altamente specifici e in
grado di essere regolati.
C12H22O11 + 12O2 <-> 12CO2 +11H2O
Specificita’: esempio
Alcol deidrogenasi di lievito:
O
||
CH3CH2OH + NAD+ <-> CH3CH + NADH + H+
Etanolo
Acetaldeide
OH
H C
Idrogeno pro-R
H
CH3
C12H22O11 + H2O <-> 12 CO2 + 11 H20
Catalisi acido-basica
Catalisi covalente: formazione di un legame covalente
transitorio tra enzima e substrato:
H2O
A-B ---> A+ B
in presenza di un gruppo nucleofilo:
H2O
H2O
A-B + X: ---> A-X + B ---> A+X: + B
Se le nuove tappe sono più veloci di quella originale, catalizza.
Catalisi favorita da ioni metallici
Orientamento
Stabilizzazione di carica
Ossido-riduzione
k1
k2
E + S " ES # E + P
k-1
Vmax = k 2 [E T ]
k1
k2
k3
E + S " ES # EP # E + P
k-1
Vmax = k cat [E T ]
kcat [E T ][S]
v=
K M + [S]
Kcat = numero di turnover
Numero di molecole di
substrato convertite in
prodotto nell’unita’ di
tempo da da una singola
molecola enzimatica
quando l’enzima e’ saturo
con il substrato
kcat [E T ][S]
v=
K M + [S]
Se [S]<<KM
!
k cat
KM
!
k cat
v=
[E T ][S]
KM
Costante di specificita’: puo’
essere limitata dalla
diffusione (108-109)
Phe -> Tyr
fenilalanina idrossilasi