Università degli Studi di Siena
XXI ciclo della Scuola di
Dottorato di Ricerca in Scienze Chimiche
Relazione I anno
Studio cristallografico di complessi enzima-inibitore di timidilato
sintasi
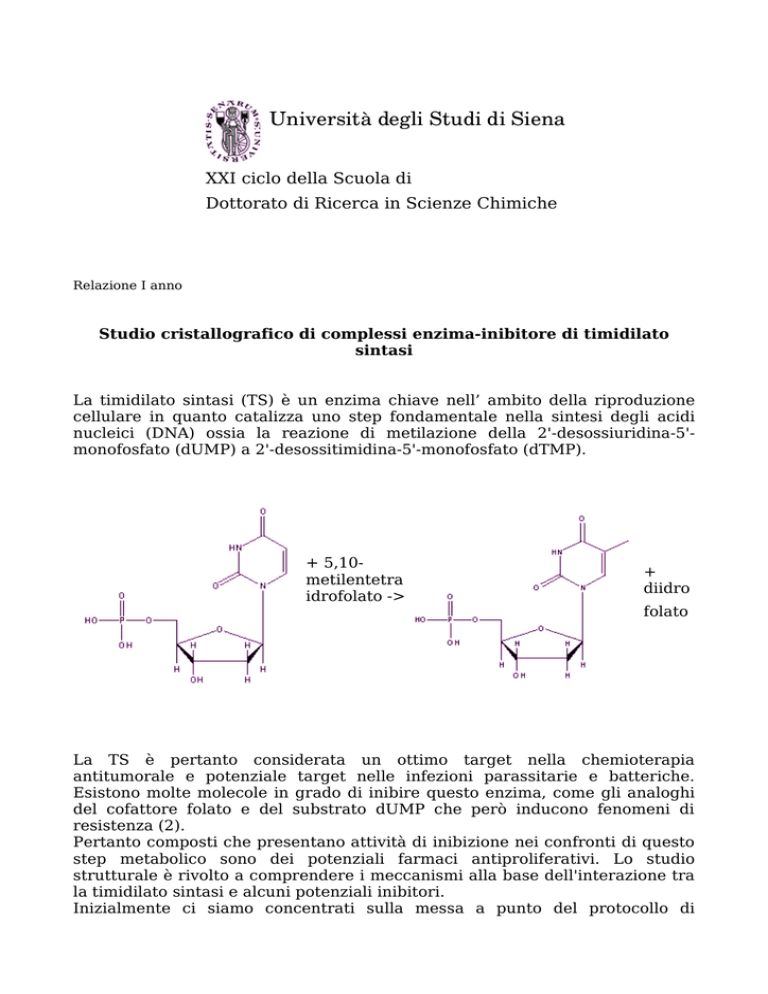
La timidilato sintasi (TS) è un enzima chiave nell’ ambito della riproduzione
cellulare in quanto catalizza uno step fondamentale nella sintesi degli acidi
nucleici (DNA) ossia la reazione di metilazione della 2'-desossiuridina-5'monofosfato (dUMP) a 2'-desossitimidina-5'-monofosfato (dTMP).
+ 5,10metilentetra
idrofolato ->
+
diidro
folato
La TS è pertanto considerata un ottimo target nella chemioterapia
antitumorale e potenziale target nelle infezioni parassitarie e batteriche.
Esistono molte molecole in grado di inibire questo enzima, come gli analoghi
del cofattore folato e del substrato dUMP che però inducono fenomeni di
resistenza (2).
Pertanto composti che presentano attività di inibizione nei confronti di questo
step metabolico sono dei potenziali farmaci antiproliferativi. Lo studio
strutturale è rivolto a comprendere i meccanismi alla base dell'interazione tra
la timidilato sintasi e alcuni potenziali inibitori.
Inizialmente ci siamo concentrati sulla messa a punto del protocollo di
cristallizzazione della proteina e dei complessi proteina+inibitore. Uno dei
problemi che abbiamo notato è stato quello legato alla solubilità degli inibitori
diversa da quella degli enzimi. Gli inibitori sono solubili in solventi organici,
mentre l'enzima cristallizza in soluzioni acquose, perciò abbiamo dovuto
trovare solventi organici totalmente o parzialmente solubili in acqua e
determinare le loro concentrazioni massime tali da essere compatibili con i
cristalli.
Abbiamo preso in esame la timidilato sintasi di due batteri: Pneumocisti carini
e Enterococcus faecalis. Per quanto riguarda TS da P. carini ho fatto uno
screening per determinare le condizioni di cristallizzazione della apo-proteina
e uno screening con la tecnica del seeding con tutti i potenziali inibitori che
erano stati scelti, mantenendo fissa la concentrazione della proteina e
variando la concentrazione di solvente organico nelle soluzioni di
cristallizzazione usate. Anche nel caso di E. faecalis ho proceduto a
determinare le condizioni di cristallizzazione ed in entrambi i casi si sono
formati alcuni aggregati cristallini. Sicuramente per migliorare l'ottenimento
dei cristalli sia della apo-proteina sia dei complessi proteina+inibitore
dovremo concentrarci soprattutto sui metodi di cristallizzazione e
cocristallizzazione e soaking.
Bibliografia
1. Sandanayaka, V. P. & Prashad, A. S. (2002). Resistance to beta-lactam
antibiotics: structure and mechanism based design of beta-lactamase
inhibitors. Curr. Med. Chem. 9, 1145-1165.
2. Jackman, A.L. et al., Anti-cancer drug design, 10, 573-589, 1995.












