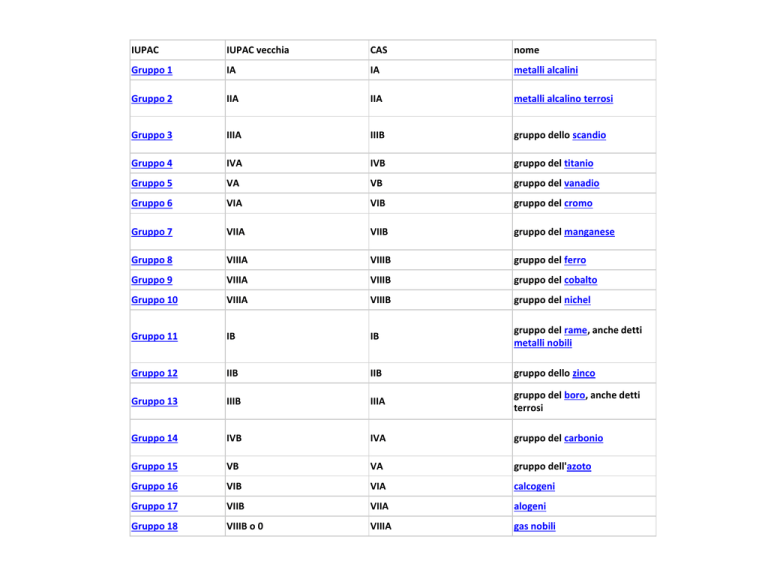
IUPAC
IUPAC vecchia
CAS
nome
Gruppo 1
IA
IA
metalli alcalini
Gruppo 2
IIA
IIA
metalli alcalino terrosi
Gruppo 3
IIIA
IIIB
gruppo dello scandio
Gruppo 4
IVA
IVB
gruppo del titanio
Gruppo 5
VA
VB
gruppo del vanadio
Gruppo 6
VIA
VIB
gruppo del cromo
Gruppo 7
VIIA
VIIB
gruppo del manganese
Gruppo 8
VIIIA
VIIIB
gruppo del ferro
Gruppo 9
VIIIA
VIIIB
gruppo del cobalto
Gruppo 10
VIIIA
VIIIB
gruppo del nichel
Gruppo 11
IB
IB
gruppo del rame, anche detti
metalli nobili
Gruppo 12
IIB
IIB
gruppo dello zinco
Gruppo 13
IIIB
IIIA
gruppo del boro, anche detti
terrosi
Gruppo 14
IVB
IVA
gruppo del carbonio
Gruppo 15
VB
VA
gruppo dell'azoto
Gruppo 16
VIB
VIA
calcogeni
Gruppo 17
VIIB
VIIA
alogeni
Gruppo 18
VIIIB o 0
VIIIA
gas nobili
Gli elementi di uno stesso gruppo hanno configurazione elettronica
esterna dello stesso tipo
Poiché sono gli elettroni esterni che entrano in gioco nei fenomeni chimici, le
proprietà degli elementi appartenenti allo stesso gruppo presentano analogie.
Da notare che queste analogie sono assai marcate fra gli elementi successivi
al secondo, mentre i primi due elementi presentano proprietà che possono
essere notevolmente differenti.
Nel V gruppo le proprietà chimico-fisiche di As, Sb e Bi sono simili, ma hanno
ben poco in comune con N e P.
Poiché aumenta la distanza degli elettroni dal nucleo (raggio atomico),
diminuisce l’energia con la quale sono legati gli elettroni esterni
Proprietà periodiche
•
•
•
•
•
•
•
•
numero di elettroni esterni
carattere metallico
energia di ionizzazione
affinità elettronica
elettronegatività
raggio atomico
raggio ionico
numero di legami
Regole
• le proprietà periodiche variano con
continuità da sinistra a destra e
dall’alto al basso
• si ripetono simili ogni 8 elementi in
successione di numero atomico
crescente
• in ogni periodo, ciascun elemento
mostra valori intermedi tra quello che
lo precede e quello che lo segue
• si ripetono con valori simili all’interno
dei gruppi
Una prima grossa divisione degli elementi della tavola periodica
consiste nel loro carattere metallico o non metallico
Il carattere metallico aumenta:
- da destra a sinistra lungo un periodo
- dall’alto al basso lungo un gruppo
Il raggio atomico
Le nuvole elettroniche non hanno dimensioni definite,
tuttavia si definisce raggio atomico la metà della
distanza che separa i centri di due atomi contigui
quando questi formano molecole o si impacchettano in
solidi.
r
Misure date in
picometri (pm)
10-12 m
Le dimensioni atomiche
Le dimensioni
atomiche
diminuiscono
muovendosi
lungo un periodo
aumentano
scendendo lungo
un gruppo
Energie di Ionizzazione
Energia di ionizzazione: Eion o energia di prima ionizzazione si definisce
come la quantità di energia necessaria per allontanare a distanza
infinita da un atomo allo stato gassoso, l’elettrone più esterno (meno
fortemente legato), formando così uno ione positivo X+
X(gassoso) + Eion X+(gassoso) + e-
L’energia di ionizzazione si esprime normalmente in elettron-Volt (eV)
relativamente ad un singolo elettrone, ovvero in Kcal-1 mol-1 riferendosi
ad una mole di elettroni.
E’ possibile “strappare” altri elettroni, quindi si possono definire le
energie di seconda, terza, etc., ionizzazione.
E’ chiaro che l’energia di seconda ionizzazione è sempre più alta di
quella di prima ionizzazione.
E = h
Energie di I e II ionizzazione in funzione del
numero atomico
Notare a quali elementi corrisponde il massimo di I ionizzazione
M → M+ + eM+ → M++ + e-
pot. di prima ionizzazione
pot. di seconda ionizzazione
Na → Na+ + eNa+ → Na++ + eNa++ → Na+++ + e-
PI1 = 5.12 eV
PI2 = 47.05 eV
PI3 = 70.70 eV
Li → Li+ + eLi+ → Li++ + eLi++ → Li+++ + e-
PI1 = 5.39 eV
PI2 = 50.0 eV
PI3 = 122.4 eV
Gli atomi tendono alla configurazione elettronica più
stabile (ns2p6, strato completamente pieno), cioè a
quella del gas nobile più vicino.
·Eion diminuisce scendendo nel gruppo perché gli
elettroni sono meno attratti dal nucleo.
·Eion aumenta passando dal 1° al 2° gruppo, (X+ ha qui
una configurazione ns2, parzialmente stabile)
diminuisce al 3° e aumenta nel resto del periodo.
Affinità elettronica
L’affinità elettronica è l’energia che viene liberata (per convenzione di
segno negativo) da un atomo neutro gassoso isolato, nel suo stato
fondamentale, quando acquista un elettrone per dare luogo alla
formazione di uno ione negativo isolato
Elemento(gassoso) + e-
Elemento (gassoso) –
Raggio ionico
L’allontanamento di elettroni da un
nucleo atomico comporta una
diminuzione delle dimensioni
atomiche (minor repulsione fra
elettroni). Al contrario, l’inserimento
di elettroni comporta un aumento
delle dimensioni (maggior repulsione
interelettronica)
Dimensioni degli ioni
L’elettronegatività
Elettronegatività è la tendenza con la quale un
atomo tende ad attrarre gli elettroni di legame.
Non è quindi un valore “assoluto” come l’affinità
elettronica
Mulliken cercò di darne una spiegazione più generale
definendola come la media tra il potenziale di ionizzazione
(E.I.) e l’affinità elettronica (E.A.).
((E.I. – E.A.)/2).
Elettronegatività degli elementi
Esercizi
Scrivere la configurazione elettronica ed il diagramma degli orbitali per
ciascuno ione e determinare se è diamagnetico o paramagnetico.
Al3+; S2-; Fe3+; Co2+; N3-; Ca2+
Bilanciare:
Cl2 + NaOH NaCl + NaClO + H2O
NaClO NaCl + NaClO3
METODO SCIENTIFICO
Consiste, da una parte, nella raccolta di
evidenza empirica e misurabile attraverso
l'osservazione e l'esperimento; dall'altra,
nella formulazione di ipotesi e teorie da
sottoporre nuovamente al vaglio
dell'esperimento.
20
21
ACCURATEZZA
L’accuratezza esprime la vicinanza del risultato
al valore vero o accettato come tale.
PRECISIONE
La precisione descrive l’accordo tra due o più
misure replicate.
22
La media e la deviazione standard
La deviazione standard () per una serie di misure è uguale alla radice quadrata
della somma dei quadrati delle differenze fra ogni misura ed il valore medio, diviso
per il numero di misure meno uno. ha un significato statistico ben preciso: se si
assume che il valor medio sia stato ottenuto a partire da molte misure, ci si deve
aspettare che il 68% dei valori raccolti sia compreso nell’intervallo valor medio ed
il 95% nell’intervallo valor medio 2.
24
NOTAZIONE SCIENTIFICA
I numeri vengono scritti come un prodotto di un
numero compreso tra 1 e 9 e una opportuna potenza
di 10.
In pratica si deve:
1 - spostare la virgola decimale dopo la prima cifra diversa
da zero
2 – moltiplicare il numero ottenuto per 10 elevato ad un
esponente uguale al numero di posizioni di cui era stata
spostata la virgola
Es:
5283 = 5,283 x 103
0,000123 = 1,23 x 10-4
25












